
题目列表(包括答案和解析)
1.下列关于氯水的叙述,正确的是( )
A.新制氯水中只含Cl2和H2O 分子
B.新制氯水可使蓝色石蕊试纸变红且不褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后pH将变小
28.(7分)如下图所示装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:
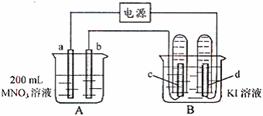 (1)a为 极,c极的电极反应式为:
(1)a为 极,c极的电极反应式为:
。
(2)电解开始时,在B烧杯的中央滴几滴淀粉溶
液,你能观察到的现象是
。电解进行一段时
间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为:
。
(3)当d电极上收集到44.8 mL气体(标准状况)时停止电解,a极上放出了 mol气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 g·moL-1;
此时,再加蒸馏水使A烧杯中的溶液体积仍为200 mL,取这种溶液加入到25.0 mL 0.100 mol·L-1的HCl溶液中,当加入31.25 mL 溶液时刚好沉淀完全,则电解前A烧杯中MNO3溶液的物质的量浓度为 mol·L-1。
27.(10分)已知乙二酸( HOOC-COOH)俗称草酸,它是一种易溶于水的二元弱酸,酸性强于碳酸,其盐草酸钙和草酸氢钙均为白色不溶物。无色晶体H2C2O4·2H2O称为草酸晶体,其熔点为101.5℃。草酸晶体失去结晶水得无水草酸,它在157℃升华。
根据上述信息,回答下列问题。
(1)向盛有2mL饱和NaHCO3溶液的试管里加入约2mL乙二酸浓溶液,观察到的现象是 ,写出该反应的离子方程式: 。
(2)请将相关物质的化学式填写在( )里并配平乙二酸与酸性KMnO4溶液反应的离子方程式;用单线桥标出该反应电子的转移情况:
MnO4- + H2C2O4 + H+ - Mn2+ + CO2↑+ ( )
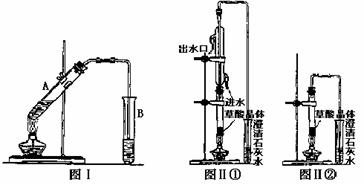
(3)向试管A中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸溶液,按下图Ⅰ连接好装置,加热3-5min。在装有饱和Na2CO3溶液的试管B中有油状且带有香味的液体产生。B中导管口在液面上而不伸入液面下的原因是 。
(4)若将乙二醇代替乙醇,请分别写出乙二酸与乙二醇等物质的量反应生成环状有机物(六元环)的结构简式 。
(5)已知草酸分解的化学方程式为: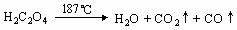 。
。
利用图Ⅱ①和图Ⅱ②加热草酸晶体,以验证草酸受热是否分解。连续加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清,其原因是
;图Ⅱ②:试管里澄清石灰水只变浑浊,其原因是 ;能验证草酸受热分解的装置是 (填图Ⅱ中的编号“①”或“②”),理由是:
(从装置的特点分析)。
26.(11分)苯的含氧衍生物A的相对分子质量为180,其中碳元素的质量分数为60%,A完全燃烧消耗O2的物质的量与生成CO2的物质的量相等。请回答下列问题:
(1)A的分子式为_________ _。
(2)A的苯环上取代基彼此相间,A能发生银镜反应,也能与NaHCO3溶液反应产生CO2,还能与FeCl3溶液发生显色反应,则A含有的官能团名称是__________ ,
写出A可能的两种结构简式: _________ 、_________ _。
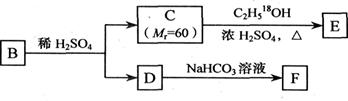 (3)A的一种同分异构体B是邻位二取代苯,其中一个取代基是羧基,B能发生右图所示转化:
(3)A的一种同分异构体B是邻位二取代苯,其中一个取代基是羧基,B能发生右图所示转化:
F的结构简式是_________________________;
写出下列反应的化学方程式:
①C→E____________________________________________________________
②D与浓溴水反应__________________________________________________
③B与足量NaOH溶液共热________________________________________
24.(8分)现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是
;
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);若将②、③溶液等体积混合后,所得溶液pH 7(选填“>”、“<”或“=”),此时溶液中除水分子外的各微粒的浓度由大到小的顺序为
(3)若将①、④溶液按体积比为2:1混合后,所得溶液pH 7(选填“>”、“<”或“=”)此时溶液中除水分子外的各微粒的浓度由大到小的顺序为 ;将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈 (填序号)。
A.酸性 B.碱性 C.中性
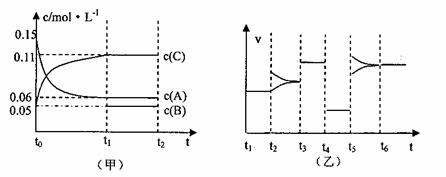 25.(7分)向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
25.(7分)向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
(1)若t1=15s,则t0-t1阶段以C浓度变化表示的反应速率v(C)为= 。
(2)若t2-t3阶段,C的体积分数变小,此阶段v(正) v(逆)(填“>”“<”“=”)
(3)t4-t5阶段改变的条件为 ,B的起始物质量为 。
(4)t5-t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
23.(13分)a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与c的最外层电子数之比为2∶3,b的最外层电子数比c的最外层电子数少1个; c与e同族;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。请用化学用语完成下列问题:
(1)e的原子结构示意图是 ;d2c2的电子式为 。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示) 。c的氢化物的沸点
(填“>”或“<”)e的氢化物的沸点,其主要原因是 。b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为
,Z的晶体类型为 。ab-离子的电子式为 。
(3)由a、c、d能形成两种常见化合物,其水溶液均显碱性,其原因分别是(用离子方程式表示) ;
。
(4)在硝酸亚铁溶液中加入d2c2,使d2c2与硝酸亚铁物质的量之比为1:2,请写出该反应的离子方程式: 。
(5)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应(无酸式盐的生成),并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为 。
22.某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
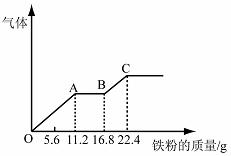 下列分析或结果错误的是
下列分析或结果错误的是
A.每份混合酸中NO3-物质的量为0.2 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为5 mol·L-1
成都石室中学高2011级8月月考化学试卷
第Ⅱ卷(非选择题 共56分)
21.下列溶液中微粒的物质的量浓度关系正确的是
 A.室温下,向0.01
A.室温下,向0.01 溶液中滴加
溶液中滴加 溶液至中性:
溶液至中性: 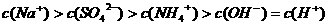
 B.0.1
B.0.1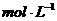
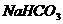 溶液:
溶液:
 C.Na2CO3溶液:
C.Na2CO3溶液: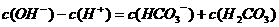
 D.25℃时,
D.25℃时,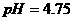 、浓度均为0.1
、浓度均为0.1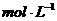 的
的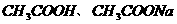 混合溶液:
混合溶液:
20.下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是
A.Fe(NO3)3与HI B.NaOH与NH4HSO4
C.HCl与Na2CO3 D.Ca(HCO3)2与Ca(OH)2
19.下列有关说法正确的是
A.接触法制硫酸的主要设备有沸腾炉、合成塔和吸收塔
B.工业制硫酸中,尾气二氧化硫是用NaOH溶液吸收的
C.工业制硫酸中,三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使三氧化硫吸收完全
D.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com