
题目列表(包括答案和解析)
8.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是 ( )
A.NH4+ NO3- CO32- Na+ B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Ca2+ K+ Cl- D.NO3- K+ AlO2- OH-
7.将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中充分反应后,放出氢气最多的是 ( )
A.3mol/LHCl B.4mol/LHNO3
C.8mol/LNaOH D.18mol/LH2SO4
6.碳酸氢钠受热容易分解为碳酸钠。现加热5.00 g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为 ( )
A.3.38 g B.4.58 g C.4.16 g D.4.41 g
5.下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是 ( )
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③少量电石投入过量NaHCO3溶液 ④Na2O2投入FeCl2溶液
A.① B.③ C.②③ D.①③④
4.下列离子方程式正确的是 ( )
A.钾跟水的反应:2K + 2H2O = 2K+ + 2OH- + H2↑
B.碳酸氢钠溶液和苛性钠溶液反应:H+ + OH- = H2O
C.过氧化钠加水:Na2O2 + H2O = 2Na+ + 2OH- + O2↑
D.小苏打和少量澄清石灰水混合:Ca2+ + OH- + HCO3- = CaCO3↓+ H2O
4.要证明某溶液中不含Fe3+而可能含有Fe2+。进行如下实验操作时最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4溶液
③加入少量KSCN溶液
A.③① B.③② C.①③ D.①②③
2.久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的是 ( )
A.过氧化钠固体 B.亚硫酸钠固体
C.硫酸亚铁晶体 D.苯酚晶体
1.关于合金性质的说法中,错误的是 ( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的物理性质不同
D.合金的化学性质一般与其各成分金属的化学性质不同
13.将铜和镁的合金完全溶于浓HNO3溶液中,若反应中HNO3被还原产生4.48L(标准状况,下同)NO2气体和0.336 L N2O4气体,向反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为8.51g,则合金的质量为( )
A.2.7g B.4.6g C.8.2g D.无法计算
第Ⅱ卷(非选择题:共176分)
26(19分).元素周期表是学习物质结构和性质的重要工具。下表是元素周期表的一部分。表中所列字母A、D、E、G、Q、M、R、T分别代表某一种化学元素。请用所给元素回答下列问题。
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D |
E |
|
|
|
|
G |
|
|
|
|
|
|
|
|
|
|
|
|
Q |
|
M |
R |
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。
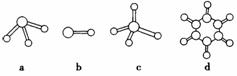 (3)M、D两元素形成的化合物中含有的化学键类型是 ,其分子是(填“极性”或“非极性”) 分子;A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式)
(3)M、D两元素形成的化合物中含有的化学键类型是 ,其分子是(填“极性”或“非极性”) 分子;A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式)
 ;A与D形成的分子的空间结构可能是(填序号) 。
;A与D形成的分子的空间结构可能是(填序号) 。
(4)由表中所给元素组成反应物,用化学方程式说明元素M、R的非金属性强弱:
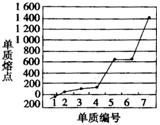
(5)第三周期主族元素单质熔点高低的顺序如图所示,“1”所代表的物质的化学式是 ,“7”所对应的元素形成的高价氧化物的晶体类型是 。
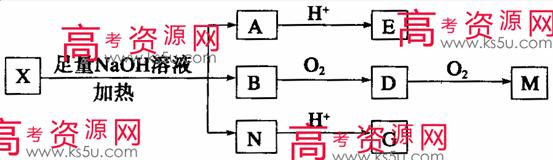
 27(12分).下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
27(12分).下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填写:
(1)写出B的电子式: 。
(2)写出生成E的电极反应式: ,反应⑤的现象是 。
(3)反应①的化学方程式是 ,在实验室中引发反应④的操作是 。
(4)反应⑥中若转移1 mol 电子,则被还原的X是
mol。
28(12分).我国化学家侯德榜改进国外的纯碱生产工艺,生产流程可简要表示如下:
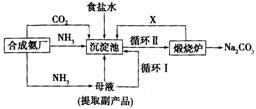
回答下列问题:
(1)沉淀池中发生反应的化学方程式为 。
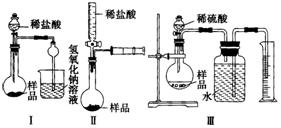
(2)该实验得到的纯碱中含有氯化钠,甲同学设计装置Ⅰ,拟通过测定烧杯中氢氧化钠溶液的增重来测定样品中碳酸钠的含量,但该实验存在明显不足,试举出该装置引起误差的两个主要原因:
① ② 。
(3)乙同学设计的测定样品中纯碱含量的方法如图Ⅱ,试回答:
①检查该装置气密性的方法为 。
②设滴定管的起始读数为V1 mL,终了读数为V2 mL,注射器测定排出的气体体积为V3 mL(标准状况),称得样品质量为m g,则原样品中碳酸钠的质量分数的表达式为 (用含V1、V2、V3、m的代数式表示)。
(4)丙同学设计的测定样品中纯碱含量的方法如图Ⅲ,并在广口瓶中的水上面滴加少量植物油,试回答:
①你认为植物油的作用是 。
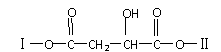 ②为减小误差,读取量筒中水的体积时的注意事项有
。
②为减小误差,读取量筒中水的体积时的注意事项有
。
29(17分). 某有机物X(C12H13O5Br)中含有多种官能团,
其结构简式为
(其中Ⅰ、Ⅱ代表未知部分的结构),为推测X的分子结构,进行如图所示的转化过程:
已知:E蒸气对O2的相对密度为2.94,其中所含碳元素的质量分数为76.6%;M(C2H2O4)能使蓝墨水褪色,G、M都能与NaHCO3溶液反应。据此作答:
(1)E的名称为 ,M的结构简式为 ,G所含官能团的名称是 。
(2)下列关于E的说法正确的是 (填序号)。
①在空气中易被氧化而变色 ②有NaOH溶液存在时可以发生消去反应 ③与乙醇具有相同的官能团和化学性质 ④可以用浓溴水检验该物质的存在
(3)G在一定条件下发生反应,生成分子式为C4H4O4的有机物(该有机物可使溴的四氯化碳溶液褪色),写出G发生此反应的化学方程式: 。
(4)X与足量NaOH反应的化学方程式 。
(5)F与G互为同分异构体,F的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两上羟基,则F的分子结构可能结构简式
12.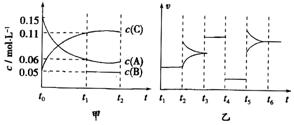 向某密闭容器中加入0.3
mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。随图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知,t3~t4阶段使用了催化剂。下列说法正确的是( )
向某密闭容器中加入0.3
mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。随图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知,t3~t4阶段使用了催化剂。下列说法正确的是( )
A.B的起始物质的量为0.02mol
B.t4~t5阶段改变的条件为降低反应温度
C.t5~t6阶段容器内A的物质的量减少0.03 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式为3A(g) B(g)+2C(g);△H=-100a kJ·mol-1
B(g)+2C(g);△H=-100a kJ·mol-1
D.若t1=15 s,生成物C在t0~t1时间段的平均反应速率为0.004 mol·L-1·S-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com