
题目列表(包括答案和解析)
12.绿原酸是咖啡提取液的成分之一,其结构如图所示。下列关于绿原酸的说法正确的是( )
A.分子中所有碳原子可能共面
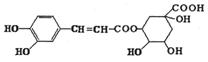 B.一定条件下,1mol该物质最多与4molNaOH反应
B.一定条件下,1mol该物质最多与4molNaOH反应
C.水解产物都可以与FeCl3溶液发生显色反应
D. 1mol该物质最多与6mol浓溴水反应
11.500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为4 mol·L-1
B.电解得到的Cu的物质的量为0.5 mol
C.电解后溶液中c(H+)为2 mol·L-1
D.向电解后溶液中加入一定量的Cu(OH)2可恢复为原溶液
10.某兴趣小组为探究温度、压强对可逆反应A(g)+B(g) 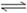 C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
|
|
A |
B |
C |
|
浓度1 |
0.05mol·L-1 |
amol·L-1 |
0.05mol·L-1 |
|
浓度2 |
0.078mol·L-1 |
0.078mol·L-1 |
0.122mol·L-1 |
|
浓度3 |
0.06mol·L-1 |
0.06mol·L-1 |
0.04mol·L-1 |
|
浓度4 |
0.07mol·L-1 |
0.07mol·L-1 |
0.098mol·L-1 |
请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是( )
A.由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应
B.由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度
C.[浓度1]中a=0.05mol·L-1
D.该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差。
9、有些单质,易溶于含同一元素的盐溶液中,如:硫易溶于硫化钾溶液中,对于由①CaCO3、
②KI、③Al(OH)3、④AgOH、⑤I2五种物质所组成的混合物,要使其每种成分逐一溶解(一次只溶解一种物质),试剂选用顺序正确的是( )
A.氨水 乙醇 水 氢氧化钾 硝酸
B.四氯化碳 水 氨水 氢氧化钠 盐酸
C.水 苯 氨水 氢氧化钾 硝酸
D.水 盐酸 氢氧化钠 氨水 乙醇
8..NA为阿伏加德罗常数,下列有关说法正确的是( )
A.78g过氧化钠晶体中,含2NA个阴离子
B.足量的铜与含2molH2SO4的浓硫酸充分反应,可生成NA个SO2分子
C.工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5 NA
D.3mol铁与足量的水蒸气充分反应,转移电子8NA个
7. 正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是( )
A. CH3COOH(aq)+NaOH(aq)=CH3COONa (aq)+H20(l)中和热为-57.3KJ/mol
B.P4、金刚石﹑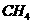 ﹑
﹑ 粒子的空间结构均为正四面体;晶体硅﹑碳化硅均为原子晶体.
粒子的空间结构均为正四面体;晶体硅﹑碳化硅均为原子晶体.
C.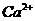 的结构示意图为
的结构示意图为
 ,
,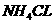 的电子式为
的电子式为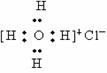
D.过氧乙酸( )与羟基乙酸(
)与羟基乙酸(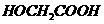 )互为同分异构体;
)互为同分异构体;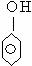 与
与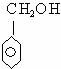 互为同系物
互为同系物
6. 生活中的某些问题,常常涉及到化学知识,下列分析正确的是( )
A. 氯气和活性炭均可作为漂白剂,若同时
B. 使用,漂白效果会明显加强
B.为了消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以单质的形式存在
C.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜要求
D.苯酚有杀菌和止痛作用,药皂中也掺有少量苯酚,所以我们可以用苯酚对环境消毒或直接涂抹于皮肤上进行消毒
21.(12分)A.⑴CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是 。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置: 周期, 族, 区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ;葡萄糖分子中碳原子杂化方式有 。
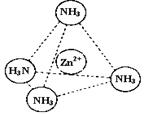
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。
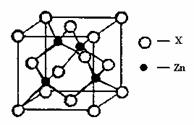
④右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
20.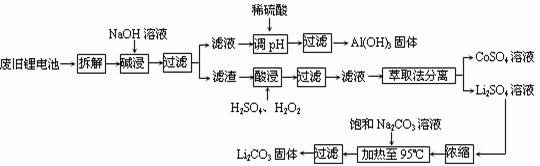 (10分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下:
(10分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下:
(1)上述工艺回收到的产物有 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。
19.(12分)将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是__________,可能有的阳离子是________.(不考虑水电离出的H+,下同)
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是________,可能含有的阳离子是________.
(3)如果反应后的溶液中无金属剩余,则加入金属粉末的最大质量应小于________.
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属粉末的最小质量为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com