
题目列表(包括答案和解析)
5.设阿伏加德罗常数的值为NA,则下列说法中正确的是
A.1molNa2O2与CO2反应产生,转移的电子数为4NA
B.标准状况下,11.2L H2O中含有的电子数为5NA
C.1mol/L Al2(SO4)3溶液中含Al3+数为2NA
D.常温常压下,14g N2所含的原子数目为NA
4.下列说法中正确的是
A.刚落下的酸雨酸性逐渐增强,是由于雨水所含成分被不断氧化的原因
B.在同一主族中,从上到下,卤素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D.钠原子在反应中失去的电子比铝原子少,故钠的金属性在理论上应弱于铝的金属性
3.下列说法中正确的是
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.沼气、天然气和水煤气分别属于化石能源、可再生能源和二次能源
2.下列说法中正确的是
A.硅是人类将太阳能转变为电能的常用材料
B.工艺师利用盐酸刻蚀石英制作艺术品
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅不涉及氧化还原反应
1.下列关于化学学习和研究的说法错误的是
A.化学模型有助于解释一些化学现象
B.质量守恒定律是大量实验事实的总结
C.化学家提出的假设都能被实验证实
D.化学基本原理的应用是有一定条件的
29.(15分)已知: 一个碳原子上连有两个羟基时,易发生下列转化:

请根据下图作答(图中无机产物均省去):

(1) C中含有的官能团的名称是 。③反应类型为 。
D的结构简式为 。
(2) 写出反应①化学方程式
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n(H2O)=2:1,则B的化学式为 。
(4)若F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应:③苯环上的一氯代物只有两种。则F在一定条件下发生加聚反应的化学方程式为
。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有 种结构,写出其中一种的结构简式_____________ 。
28.(18分)饱和盐溶液W的电解产物发生下列系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其它产物已略去),其中A、B、C、D、E在常温下均为高中化学中常见气态物质,X和K是中学常见的金属单质,氧化物Y是一种比较好的耐火材料。H可溶于强酸强碱。

回答下列问题:
①W的名称是 ,G的俗名是 。
②A分子的空间构型是 。
③反应(3)的化学方程式是 。
反应(4)的化学方程式是 。
④饱和盐溶液W电解的离子方程式是 。
⑤已知C的燃烧热为285.8kJ/mol。试写出C完全燃烧生成液态物质的热化学方程式 。
27.(17分)(1)(3分)下列有关实验的叙述,正确的是(填序号) 。
A.制备 时,盛NaOH溶液的胶头滴灌伸入到试管中的液面以下
时,盛NaOH溶液的胶头滴灌伸入到试管中的液面以下
B.如果苯酚浓溶液粘到皮肤上,应立即用酒精洗
C.测定溶液的pH时,用蒸馏水润湿过的pH试纸浸入待测液中,再与标准比色卡比较
D.用浓氨水洗涤做过银镜反应的试管
E.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
F.用浓硫酸作催化剂将纤维素水解后,加入新制的氢氧化铜悬浊液,加热,可根据是否产生红色沉淀判断该水解液是否含有醛基
(2)(14分)已知碱金属或碱土金属(ⅡA)与 在隔绝空气加热时可以发生反应,生成离子型金属氢氧化物,如NaH﹑
在隔绝空气加热时可以发生反应,生成离子型金属氢氧化物,如NaH﹑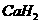 等,它们易于水反应。现有甲乙两位同学分别设计了制备
等,它们易于水反应。现有甲乙两位同学分别设计了制备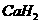 的实验,装置如图所示(分别以序号Ⅰ﹑Ⅱ表示),铁架台等夹持固定仪器已略去。请回答下列问题:
的实验,装置如图所示(分别以序号Ⅰ﹑Ⅱ表示),铁架台等夹持固定仪器已略去。请回答下列问题:
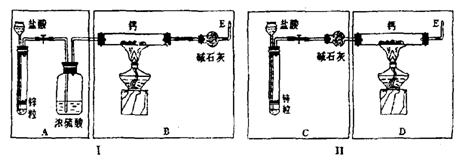
①最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置Ⅰ的不足之处是 ,
装置Ⅱ的不足之处是 。
②请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取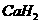 的合理装置(用序号A﹑B﹑C……表示)
;
的合理装置(用序号A﹑B﹑C……表示)
;
③检查完装置的气密性后,为了保证产品的纯度和实验安全必须先 ,然后再 ,才能点燃酒精灯加热。同样,为了安全,反应开始后,在E口处应 ;
④军事和气象野外作业常用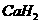 做生氢剂,使之与水反应产生
做生氢剂,使之与水反应产生 ,其反应的化学方程式为:
。
,其反应的化学方程式为:
。
26.(10分)A、B、C、D均为4种常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性正好相反;C+的焰色反应呈黄色。
⑴C元素在周期表中的位置是 ;液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式为 。
⑵M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。 则M为 、N为 (填化学式);若将0.1mol·L-1M和0.2mol·L-1N两溶液等体积混合所得溶液中离子浓度的大小顺序为 。
13. 列叙述中正确的是( )
A.将pH = 3的一元弱酸HA和pH = 11的NaOH溶液混合后溶液显碱性,一定有:
c(H+) < c(OH- )< c(A-) <c(Na+)
B.在常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,体积为20 mL,则溶液的pH = 12+lg2
C.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH )
D.将0.2 mol·L-1的盐酸与0.1 mol·L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com