
题目列表(包括答案和解析)
8. 氯水中存在多种分子和离子,可通过实验的方法加以确定。下列有关氯水中存在的粒子的说法错误的是 A. 加入含有 NaHSO4的石蕊试液,红色褪去, 说明有Cl2分子存在 B.加入有色布条后,有色布条褪色,说明有 HCIO 分子存在 C.氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在 D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有 Cl-存在
7. 下列各组离子,在指定的条件下能大量共存的是 A.使 pH 试纸呈红色的溶液:Fe2+、NH4+、Cl-、NO3- B.pH=13的溶液:S2-、SO32-、SO42-、Na+ C.使红色石蕊试纸变蓝色的溶液:K+、HCO3-、Br-、Ba2+ D.含有溶质为K2SO4的溶液:AlO2-、Na+、Al3+、Ba2+
6. 下列反应中,既是离子反应,又属于有颜色变化的氧化还原反应的是 A.硫酸铁溶液和氢氧化钠溶液混合 B.钠块投人水中 C. HCl和 NH3反应生成NH4Cl固体 D. 酸性 KMnO4溶液中通人 SO2气体
5. 用NA表示阿伏加德罗常数的数值,下列说法正确的是 A.在标准状况下, 2.24L 苯中含有 0.6NA个碳原子 B. 1 L PH=l的硫酸溶液中含有0.2NA个氢离子 C. 1 L 1 mol·L-1的 FeC13 溶液中,含有铁离子的数目为NA D. t ℃ 时,1 L pH=6的纯水中,含有10-6NA个OH-
4. 2006年10月29日,我国自主研发的通信广播卫星“鑫诺二号”发射成功。发射该卫星的“长征三号乙”运载火箭采用的是世界上最先进的液氢/液氧推进剂。现有氢气和氧气反应的两个热化学方程式: ①2H2(g)+O2(g)=2H2O(l); ΔH1=-571.6 kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g); ΔH2=-482.6 kJ·mol-1 则H2的燃烧热为 A. 571.6 kJ·mol-1 B. 482.6 kJ·mol-1 C. 285.8 kJ·mol-1 D. 241.3 kJ·mol-1
3. 下列变化过程中,无化学键断裂或生成的是 A. 石墨转化为金刚石 B. NaCl晶体溶于水 C. 碘升华 D. 久置的KI溶液呈黄色
2. 分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“Na2SiO3”的所属分类不正确的是 A.电解质 B.弱酸盐 C.强碱盐 D. 共价化合物
1. 美国科学家最近发明了利用眼泪来检测糖尿病的装置,其原理是用氯金酸钠(NaAuCl4)溶液与眼泪中的葡萄糖反应生成纳米金单质颗粒(直径为20 nm -60 nm )。下列有关说法错误的是 A. 检测时NaAuCl4发生氧化反应 B.葡萄糖的结构简式为 CH2OH (CHOH)4CHO C.葡萄糖具有还原性 D.纳米金颗粒分散在水中所得的分散系能产生丁达尔效应
18.(12分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是___________________
____________________________________________________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③___________________。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①步骤a中进行定容操作时视线应 ,
直到 。
②上述测定过程中需用溶液润洗的仪器有__________________。
③计算上述样品中CaCl2·2H2O的质量分数为______________。
④若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),某同学认为偏高的原因可能是样品中存在少量的NaCl,要验证该同学的观点应进行的实验为 (填实验名称)。
17.(21分)I.(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能随即发生剧烈反应的是(填序号,下同) ,常温下缓慢反应(或微热后能发生剧烈反应)的是 ,常温下不反应,但加热后发生剧烈反应的是 ,加热也不发生反应的是 。由此可以得到上述四种酸氧化性由强到弱的顺序是: 。
(2)工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是 (填序号)
A.Cu + HNO3(浓)Cu(NO3)2 B.Cu + HNO3(稀)Cu(NO3)2
C.Cu空气△ CuO浓硝酸 Cu(NO3)2 D.Cu浓硫酸△ CuSO4Ba(NO3 Cu(NO3)2
(3)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
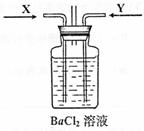 A.通入X气体后产生白色沉淀
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是:
A.HNO3的酸性比H2SO4强 B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸 D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
Ⅱ.下图是用过量的铜与40mL稀硝酸在100mL烧瓶中反应制取一氧化氮气体的实验装置图,请回答下列问题:

(1)反应刚开始时的现象是__________________________________________________,
反应停止时的现象是____________________________________________________,
(2)请在右框中画出气体收集装置的装置图。
(3)①从烧瓶中取出少量反应后的溶液,滴入少量氨水,写出该反应的离子方程式:
_______________________________________________________________
②反应结束后,能否采取向烧瓶中再加入稀硫酸的方式,再获得一氧化氮气体?如果可以,请写出反应的离子方程式,如果不可以,请说明理由:
_______________________________________________________________
(4)检查上图装置气密性的操作是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com