
题目列表(包括答案和解析)
18. (12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。 (l)写出工业上高炉炼铁的化学方程式: 。 (2)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是可燃性气体,则其反应的化学方程式为 。 (3)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。 ① 原电池反应: 负极:2Fe-4e-=2Fe2+、正极: ② 氢氧化物的形成: Fe2 + + 2OH-= Fe(OH)2 ↓、 ③ 氢氧化物的分解: 2Fe(OH)3 =Fe2O3+3H2O。 (4)为了防止铁生锈,可在铁制品表面镀上一层铜(如右图装置),则直流电源a端是 (填“正极”或“负极”),铁制品表面发生的电极反应式为 。
17. (8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。 (l)阴影部分元素 N 在元素周期表中的位置为 。根据元素周期期律,请你预测H3AsO4、H3PO4的酸性强弱 (2)判断表中Bi和Te两种元素的金属性强弱:Bi Te(填“>”、“<”或“=”)。 (3)Br2具有较强的氧化性,SO2具有较强的还原性,请写出SO2气体通入溴水后反应的离子方程式: 。
16.
(12分)已知KMnO4和 H2C2O4(草酸)在酸性溶液中会发生如下反应:
2KMnO4 +5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O(生成的Mn2+又能起催化作用,加快反应速率)。
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下(实验中所用 KMnO4溶液均已加入H2SO4):
(1)甲组:通过测定单位时间内生成 CO2气体体积的大小来比较化学反应速率的大小
 实验装置如上图,实验时分液漏斗中 A 溶液一次性放下, A、B的成分见下表:
实验装置如上图,实验时分液漏斗中 A 溶液一次性放下, A、B的成分见下表:
|
序号 |
A 溶液 |
B 溶液 |
|
① |
2mL
0.1mol·L-1H2C2O4溶液 |
4mL
0.01mol·L-1KMnO4溶液 |
|
② |
2mL
0.2mol·L-1H2C2O4溶液 |
4mL
0.01mol·L-1KMnO4溶液 |
|
③ |
2mL
0.2mol·L-1H2C2O4溶液 |
4mL
0.01mol·L-1KMnO4溶液 少量 MnSO4 |
该实验探究的是
和催化剂对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得 CO2的体积由大到小的顺序是
(用实验序号填空)。
(2)乙组:通过测定 KMnO4溶液褪色所需时间的多少来比较化学反应速率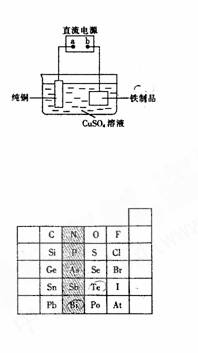 的大小
取两支试管各加入 2mL0.1mol·L-1
H2C2O4
溶液,另取两支试管各加入 4 mL 0. 1mol·L-1KMnO4溶液。将四支试管分成两组(各有一支盛有 H2C2O4溶液和 KMnO4溶液的试管) , 一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究
对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是
。
的大小
取两支试管各加入 2mL0.1mol·L-1
H2C2O4
溶液,另取两支试管各加入 4 mL 0. 1mol·L-1KMnO4溶液。将四支试管分成两组(各有一支盛有 H2C2O4溶液和 KMnO4溶液的试管) , 一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究
对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是
。
15.
(
10 分)某校课外实验小组同学设计了如图装置制取并收集一瓶气体,请帮助该小组同学完成下表。

|
制取的气体 |
药 品 |
化学方程式 |
|
O2 |
、
|
|
|
H2 |
乙醇、
|
|
14. 阿伏加德罗曾做过这样一个实验:"一抽空的密闭容器重Mg,在标准状况下,盛满CH4气体后,称重为(M+Q ) g 。把CH4气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的 边托盘上置 g砝码 …… ”横线上分别应填的是 A.右;( M+2Q) B.右;(M+4Q ) C. 左;(M+2Q) D.左;(M+4Q)
第Ⅱ卷(非选择题 共66分)
13.
A是一种常见的单质, B、C为中学常见的化合物, A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去) :
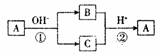 下列判断正确的是
A. X 元素一定为金属元素 B.X 元素一定为非金属元素
C.反应①和②互为可逆反应 D.反应①和②
不可能都是氧化还原反应
下列判断正确的是
A. X 元素一定为金属元素 B.X 元素一定为非金属元素
C.反应①和②互为可逆反应 D.反应①和②
不可能都是氧化还原反应
12. 下列各组物质中都有两组分,两组分各取 1 mol ,在足量氧气中燃烧,两者消耗氧气的物质的量相同的是 A. 乙烯和乙醇 B.甲醇和乙醛 C.丁烷和乙酸乙酯 D.葡萄糖和乙酸
11. 现有常温下pH均等于5的HCl溶液和NH4Cl溶液,下列说法正确的是 A. 两溶液中n (H+)相等 B. 两溶液中c(Cl-)相等 C.两溶液中c(OH-)相等 D.两溶液中水的电离程度相等
10. 下列反应的离子方程式正确的是 A.将铜片投入足量稀硝酸中:Cu +NO3-+4H+= Cu2++NO↑+2H2O B. 二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O C.硫酸溶液与氢氧化钡溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O D.钠与 CuSO4溶液反应:2Na+Cu2+=2Na++ Cu
9. 一般来说,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质。下列关于同主族元素所形成的物质的性质推理中,正确的是 A. Na 与 Cl2反应能形成离子键,故 K与 Cl2反应也能形成离子键 B. Cl2 能置换出 NaBr溶液中的溴,故I2也能置换出NaBr溶液中的溴 C.Li在氧气中燃烧生成 Li2O,故Na在氧气中燃烧也生成Na20 D. C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com