
题目列表(包括答案和解析)
7.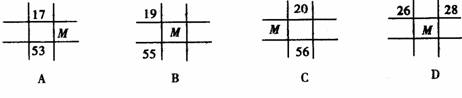 下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是 ( )
下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是 ( )
6.在一定温度下,向饱和的烧碱溶液中放入一定量的Na2O2,充分反应后恢复到原来的温度。下列说法中正确的是 ( )
A.溶液中OH-总数不变,有O2放出
B.溶液中Na+的物质的量浓度增大,有O2放出
C.溶液中Na+总数减少,有O2放出
D.溶液pH增大,有O2放出
5.下列反应中生成物总能量高于反应物总能量的是 ( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
4.在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是 ( )
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
3.下列关于热化学反应的描述中正确的是 ( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程为
CO(g)+1/2O2(g)===CO2 (g);△H=-283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
2.下列有关钠的叙述中错误的是 ( )
A.电解法冶炼金属钠时,钠在阳极析出
B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C.钠的还原性很强,可以用来冶炼金属钛、锆、铌等
D.钠的质地软,可用小刀切割
1.下列叙述正确的是 ( )
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C.在CaO和SiO2晶体中都不存在单个小分子
D.甲烷是对称平面结构,是非极性分子
19.(14分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2, X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 .
(2)元素D.E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 .
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 .
|
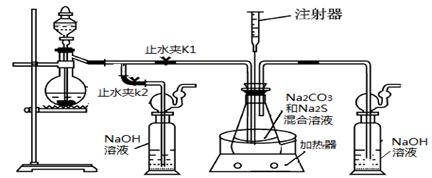 2Na2 S +Na2CO3 + 4SO2= 3Na2S2O3
+CO2。根据要求回答问题:
2Na2 S +Na2CO3 + 4SO2= 3Na2S2O3
+CO2。根据要求回答问题:
(1)实验时,打开K1,关闭K2,最后洗气瓶中发生反应的离子方程式是 。
(2)锥形瓶内溶液pH小于7时会导致产品分解,因此实验过程中需要控制锥形瓶内溶液的pH。
①反应过程中,锥形瓶中溶液pH将________(填“增大”、“减小”或“保持不变”)。
②测量锥形瓶中溶液pH时,用注射器吸取溶液样品比直接打开锥形瓶中瓶塞取样,除操作简便外,还具有的优点是 。
③若实验过程中测得溶液pH已接近于7。此时应该进行的操作是 。
(3)已知:2Na2 S2O3 +I2=2NaI+ Na2 S4O6。实验结束后进行相关处理,可即获得Na2 S2O3 ·5H2O晶体。为测量其纯度,取晶体样品mg,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是 。
(4)制取硫代硫酸钠的另一种方法是直接将硫粉和亚硫酸钠、水混合共热制取。为探究制取硫代硫酸钠最佳条件(溶液pH、亚硫酸钠浓度、反应温度、硫粉质量),设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
|
实验序号 |
溶液pH |
亚硫酸钠与水的质量比 |
反应温度 |
硫粉质量 |
亚硫酸钠转化率 |
|
1 |
10 |
1.5:1 |
100 |
18 |
80.7% |
|
2 |
a |
1.1:1 |
100 |
18 |
94.6% |
①实验1、2的目的是探究亚硫酸钠浓度对亚硫酸钠转化率的影响,则a=
②若还要探究溶液pH、反应温度、硫粉质量对亚硫酸钠转化率的影响,除实验1、2外,至少还需进行 次对比实验
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响。为什么?
答:________________________________________ ___。
18.(8分)(1)配平氧化还原反应方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol。
17.(7分) 如图,将铜片和锌片焊接在一起组成A电极,B为碳棒进行电解实验,电解液中含硝酸银和硝酸铜各0.1 mol。已知电路中通过0.2 mol电子。
(1)请写出A.B两极发生反应的电极反应式A:
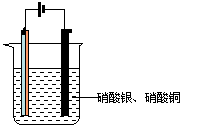 B:
B:
(2)请分析A.B两极质量变化情况为
A:
B: A B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com