
题目列表(包括答案和解析)
17.(7分) 如图,将铜片和锌片焊接在一起组成A电极,B为碳棒进行电解实验,电解液中含硝酸银和硝酸铜各0.1 mol。已知电路中通过0.2 mol电子。
(1)请写出A.B两极发生反应的电极反应式A:
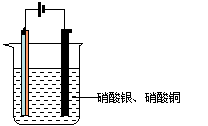 B:
B:
(2)请分析A.B两极质量变化情况为
A:
B: A B
16.(10分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在。实验中从海藻提取碘的流程图如下:
 晒干
浸泡
晒干
浸泡
灼烧
①
④ B
③
(1)指出提取碘的过程中有关的实验操作名称① 写出过程②中有关反应的离子方程式:
(2)提取碘的过程③中可选择的有机试剂为
A.酒精、四氯化碳 B.四氯化碳、苯
C.汽油、 醋酸 D.汽油、甘油
(3)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
(4)在过程④的操作中发现晶体碘大量附着在烧瓶内壁上,是由于碘具有 性质
15.已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.镁铝合金5.1g溶于300mL2mol/LHCl溶液时,在标准状况下产生气体5.6L。若向反应后的溶液中加入过量烧碱溶液,则产生沉淀的质量为A.5.8gB.7.8gC.10.4gD.13.6g加的烧碱溶液pH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
14.下列各组离子在指定条件下,一定能大量共存的是
A.使石蕊试液变红色的溶液中:K+ 、Na+ 、CO32- 、NO3-
B.在酸性高锰酸钾溶液中:
C.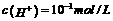 的溶液中:
的溶液中: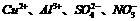
D.水电离出的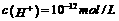 的溶液中:
的溶液中: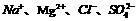
13.NA代表阿伏加德罗常数,下列叙述错误的是 ( )
A.一定温度下,1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液含NH4+物质的量不同
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
12.下列说法中正确的是 ( )
A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动
C.分子晶体的熔沸点很低,常温下都呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
11.Na3N是离子化合物,它和水作用可产生NH3,下列说法正确的是 ( )
A.Na+和N3-的电子层结构都与氩原子相同
B.Na3N与盐酸反应可生成两种盐
C.Na+的半径大于N3-的半径
D.Na3N和水反应时,Na3N是还原剂
10.以下对化学反应知识的归纳和总结中,正确的是 ( )
A.酸跟活泼金属反应一定生成盐和氢气 B.碱能跟一切非金属氧化物反应
C.单质和化合物的反应一定是置换反应 D.置换反应不一定要在溶液中进行
9.向盛有Cl2的三个集气瓶甲、乙、丙中各加入下列液体中的一种,经振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是 ( )
①AgNO3溶液 ②NaOH溶液 ③水

A.①②③ B. ②①③ C.③②① D.①③②
8.铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag =Tl+ +2Ag+ 且已知 Ag+ +Fe2+ = Ag + Fe3+ 则下列推断正确的是 ( )
A.Tl+ 最外层有3个电子 B.氧化性:Tl3+ >Ag+>Fe3+
C.还原性:Tl+ >Ag D.铊位于第五周期IIIA族
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com