
题目列表(包括答案和解析)
8.已知某溶液中存在 四种离子,其浓度大小有如下关系
四种离子,其浓度大小有如下关系
①
②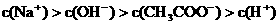
③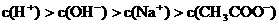
④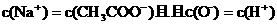
其中正确的是 ( )
A.①②③ B.①②④ C.①③④ D.②③④
7. 下列离子方程式书写正确的是 ( )
下列离子方程式书写正确的是 ( )
A.用石墨为电极电解硫酸铜溶液:Cu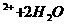 Cu+4H
Cu+4H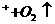
B.泡沫灭火器工作时化学反应:
C.硫酸镁溶液与氢氧化钡溶液反应: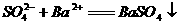
D.过量碳酸氢钠溶液与氢氧化钡溶液反应:
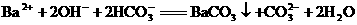
6.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性
②取少量溶液中入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体
③在上述溶液中再滴加Ba(NO3)3溶液,产生白色沉淀
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀
根据实验以下推测正确的是 ( )
A.一定有 离子 B.一定有
离子 B.一定有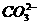 离子
离子
C.Cl-离子一定存在 D.不能确定HCO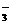 离子是否存在
离子是否存在
5.25°C时,几种弱酸的电离常数如下
|
弱酸化学式 |
CH3COOH |
HCN |
H2S |
|
电离常数(25°C) |
1.8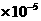 |
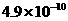 |
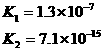 |
25°时,下列说法正确的是 ( )
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.某浓度HCN的水溶液pH=d,则其中c(OH-)=10-dmol/L
D.NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)===c(OH-)+c(HS-)+2c
(S2-)
4. 对于平衡体系2SO2(g)+O2(g) 2SO3(g) △H<0。下列结论中正确的是( )
对于平衡体系2SO2(g)+O2(g) 2SO3(g) △H<0。下列结论中正确的是( )
A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.5倍
B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量这比为2:1
C.若从平衡体系中分离出SO2,则有利于提高SO2的转化率和加快正反应速率
D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2
3.下图装置中,小试管内为红墨水,具支试管内盛有ph=4的雨水和生铁片。观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合适的是 ( )
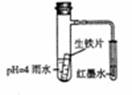 A.生铁片中的碳是原电池的负极,发生还原反应
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为:O2+2H2O+4e-====4OH-
D.具支试管中溶液pH逐渐减小
2.下列操作后,溶液pH减小的是 ( )
A.适当升高Na2CO3溶液的温度 B.往氨水中加入NH4Cl固体
C.往氨水中加入CaCO3固体 D.用石墨作电极电解NaCl溶液
1.下列有关化学反应原理的应用叙述正确的是 ( )
A.用明矾净水是因为Al2+水解生成的Al(OH)3胶粒具有很强的吸附性
B.合成氨生成过程中,采用高温高压都是为了提高N2、H2转化率
C.往铁钉镀铜时,用铜做阴极
D.电解饱和食盐水制烧碱,NaOH在阳极区域产生
19.(14分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 .
(2)元素D.E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 .
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 .
|
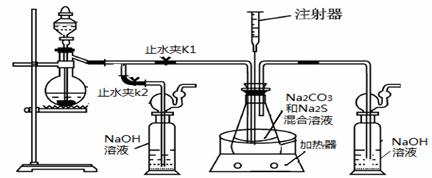 2Na2 S +Na2CO3 + 4SO2= 3Na2S2O3
+CO2。根据要求回答问题:
2Na2 S +Na2CO3 + 4SO2= 3Na2S2O3
+CO2。根据要求回答问题:
(1)实验时,打开K1,关闭K2,最后洗气瓶中发生反应的离子方程式是 。
(2)锥形瓶内溶液pH小于7时会导致产品分解,因此实验过程中需要控制锥形瓶内溶液的pH。
①反应过程中,锥形瓶中溶液pH将________(填“增大”、“减小”或“保持不变”)。
②测量锥形瓶中溶液pH时,用注射器吸取溶液样品比直接打开锥形瓶中瓶塞取样,除操作简便外,还具有的优点是 。
③若实验过程中测得溶液pH已接近于7。此时应该进行的操作是 。
(3)已知:2Na2 S2O3 +I2=2NaI+ Na2 S4O6。实验结束后进行相关处理,可即获得Na2 S2O3 ·5H2O晶体。为测量其纯度,取晶体样品mg,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是 。
(4)制取硫代硫酸钠的另一种方法是直接将硫粉和亚硫酸钠、水混合共热制取。为探究制取硫代硫酸钠最佳条件(溶液pH、亚硫酸钠浓度、反应温度、硫粉质量),设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
|
实验序号 |
溶液pH |
亚硫酸钠与水的质量比 |
反应温度 |
硫粉质量 |
亚硫酸钠转化率 |
|
1 |
10 |
1.5:1 |
100 |
18 |
80.7% |
|
2 |
a |
1.1:1 |
100 |
18 |
94.6% |
①实验1、2的目的是探究亚硫酸钠浓度对亚硫酸钠转化率的影响,则a=
②若还要探究溶液pH、反应温度、硫粉质量对亚硫酸钠转化率的影响,除实验1、2外,至少还需进行 次对比实验
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响。为什么?
答:________________________________________ ___。
18.(8分)(1)配平氧化还原反应方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com