
题目列表(包括答案和解析)
18.(10分)
(1)甲烷是一重要的清洁能源、请写出以KOH溶液为电解质溶液,甲烷燃料电池的正极反应式: 。
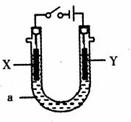 (2)电解原理在化学工业中有广泛的应用。图中a为电解液,X
(2)电解原理在化学工业中有广泛的应用。图中a为电解液,X
和Y是两块电极板,则:
①若X和Y分别为铁和石墨,a为饱和食盐水,
则电解时X电极反应式为 。
②若X、Y分别为石墨和铁,a为饱和食盐水,则电解
过程中生成的白色固体露置在空气中,可观察到的现象是
。
(3)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。电解完毕后,某兴趣小组欲对电解溶中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线如下图。
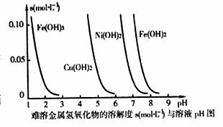
①结合右图分析,相同温度下Kap[Cu(OH)2]、Kap[Ni(OH)2]、Kap[Fe(OH)2]由大到小的顺序为 。
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu2+、Fe2+和Ni2+沉淀的先后顺序依次为 (填写离子符号)。
选做部分
共4道题,考生必须从《物质结构与性质》、《有机化学基础》中选择一个模块的2道题作答。
17.(10分)CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) 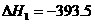 kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) 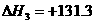 kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的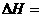 。
。
 (2)在10L密闭容器中充有10
molCO 与20molH2,
(2)在10L密闭容器中充有10
molCO 与20molH2,
在催化剂作用下反应生成甲醇:
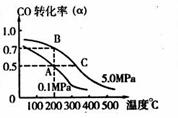
 CO(g)+2H2(g) CH3OH(g);CO的转化率(
CO(g)+2H2(g) CH3OH(g);CO的转化率(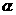 )
)
与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,
则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
16.关于下列图示的说法正确的是 ( )
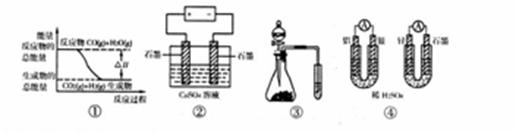
 A.图①表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)中的△H大于0
A.图①表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)中的△H大于0
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定
为1:1
C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
第Ⅱ卷(非选择题,共60分)
第Ⅱ卷共6道题。其中17、18题是必做部分,19-22题为选做部分。
必做部分
15. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I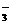 (aq) △H=Q,某I2、KI混合溶液中,I
(aq) △H=Q,某I2、KI混合溶液中,I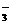 的物质的量浓度c(I
的物质的量浓度c(I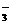 )与温度T的关系如图所示(曲线上任何一点表示平衡状态)。下列说法正确的是 ( )
)与温度T的关系如图所示(曲线上任何一点表示平衡状态)。下列说法正确的是 ( )
 A.反应:I2(aq)+I-(aq) I
A.反应:I2(aq)+I-(aq) I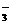 (aq) △H=Q,的Q>0
(aq) △H=Q,的Q>0
B.若温度为T1、T2反应的平衡常数分别为K1,K2,则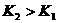
C.若反应进行到状态D,一定有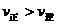
D.状态A与状态B相比,状态A的c(I2)大
14.有关甲、乙、丙、丁四个图示的叙述正确的是 ( )
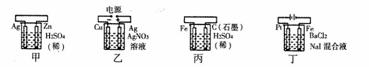
A.甲中负极反应式为:2H++2e-=H2↑
B.乙中阳极反应式为:Ag++e-=Ag
C.丙中H+向石墨棒方向移动
D.丁中电解开始时阴极产生黄绿色气体
13.在下列各组溶液中的离子一定能大量共存的是 ( )
A.加入KSCN溶液显红色的溶液:K+、NH 、Cl-、I-
、Cl-、I-
B.常温下,pH=1的溶液:Fe3+、Al3+、Br-、SO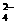
C.滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO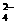
D.含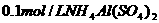 的溶液:K+、Ca2+、NO
的溶液:K+、Ca2+、NO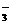 、OH-
、OH-
12.用CH4催化还原NO2可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2(g)△H=-1160kJ·mol-1
下列说法不正确的是 ( )
A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(L)△H>-574kJ·mol-1
B.等物质的量的CH4参加反应时,放出的热量为17.34kJ
C.若用0.2moLCH4还原NO2至N2,放出的热量为17.34kJ
D.若用0.02moLCH4还原NO2至N2,整个过程中转移的电子总数为0.16mol
11.t°C时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下该反应的平衡常数表达式为: ,有关该平衡体系的说法正确的是 ( )
,有关该平衡体系的说法正确的是 ( )
A.升高温度,平衡常数K一定增大
B.增大压强,W(g)质量分数增加
C.该反应的化学反应方程式为X+2Y 2Z+2W
D.增大X(g)浓度,平衡向逆反应方向移动
10.氯气溶于水达到平衡后,下列叙述正确的是 ( )
A.再通入少量氯气, 减小
减小
B.通入少量SO2,溶液的漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.该反应的离子方程式为Cl2+H2O=H++Cl-+HClO
9.向三份0.1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2CO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com