
题目列表(包括答案和解析)
6.等体积的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质和量浓度的AgNO3溶液
恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是
A.1:2:3 B.3:2:1 C.6:3:2 D.1:1:1
5.下列各组物质的分类正确的是
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③非极性分子:CO2、CC14、CH2C12、对二甲苯 ④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯,二乙酸乙二酯
A.②⑤ B.②④⑤⑦ C.②⑤⑥⑦ D.全部正确
4.钛(Ti)被称为继铁、铝之后的第三金属,以TiO2 制取Ti的主要成分有:
①TiO2+2C+2Cl2 TiCl4+2CO
②TiCl4+2Mg
TiCl4+2CO
②TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
下列叙述正确的是
A.反应①是置换反应 B .反应②是复分解反应
C.反应①中TiO2 是氧化剂 D. 反应②中金属镁是还原剂
3.下列叙述中正确的是
A.金属阳离子被还原不一定得到金属单质
B.某元素从化合态变为游离态时,该元素一定被还原
C.有单质生成的反应一定是氧化还原反应
D.在氧化还原反应中,非金属单质一定是氧化剂
2.列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A. SO+H2O=H2SO4 B. 2Na2O2+2H2O=4NaOH+O2 ↑
C.2F2+2H2O=4HF+O2 D. 2Na+2H2O=2NaOH+H2↑
1.经分析知道某物质中只含有一种元素,则该物质
A.不可能是混合物 B. 不可能是化合物
C.一定是单质 D.一定是纯净物
22.(21分)下图中,A无酸性,不能水解,在一定条件下发生消去反应可得到两种互为同分异构体的产物,其中一种B含有一个甲基,可用于制取合成树脂、染料等多种化工产品。E能使溴水退色,不能发生银镜反应。试回答下列问题:
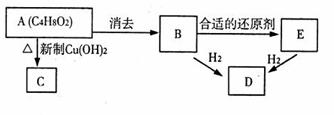
(1)写出E的结构简式 。
(2)D中官能团的名称是 。E生成D的反应类型是 ,A生成C的反应类型是 。
(3)写出A生成C的化学反应方程式 ,B可以制取合成树脂,写出B在一定条件下生成聚合物的化学反应方程式 。
(4)C的同分异构体C1与C具有相同的官能团,两分子C1脱去两分子水形成含有六元环的化合物,写出C1可能的结构简式 、 。
21.(19分)化合物A(C8H8O3)为无色液体、难溶于水、有特殊香味的物质,从A出发可发生如图所示的一系列反应,化合物A硝化时可生成2种一硝基取代物,化合物H分子式为C6H6O,G能发生银镜反应。(已知RCOONa+NaOH RH+Na2CO3)
RH+Na2CO3)
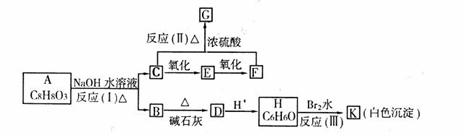
请回答:
(1)写出化合物A的结构简式 ,E中含氧官能团的名称是 。
(2)反应类型:(I) ,(Ⅱ) ,(Ⅲ) 。
(3)写出下列反应的化学方程式
①H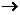 K:
K:
②C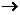 E:
E:
③C+F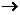 G:
G:
20. (19分)图表法、模型法是常用的科学研究方法。
(19分)图表法、模型法是常用的科学研究方法。
I.下图是研究部分元素的氢化物的沸点变化规律的图像。
不同同学对某主族元素氢化物的沸点的变化趋势画
出了两条折线--折线a和折线b(其中A点对
应的沸点是100℃),你认为正确的是
,理由是
。
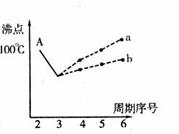
 II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为
。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种
化合价,其中以+4价的Ti最为稳定。偏钛酸
钡的热稳定性好,价电常数高,在小型变压器、
话筒和扩音器中都有应用。偏钛酸钡晶体中晶
胞的结构示意图如右图,则它的化学式是
。
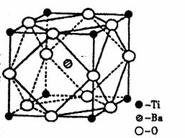
 III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图
正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置
。
(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是 (填字母代号)
A.氙的含量比较丰富 B.氙的相对原子质量大
C.氙原子半径大,电离能小 D.氙原子半径小,电负性大
(3)已知XeO3分子中氙原子上有1对弧对电子,则XeO3为 分子(填“极性”或“非极性”)。
19.(21分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
 试回答下列问题:
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式 。
(2)d与a反应的产物的分子中中心原子的杂化形式为 。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: 。
(4)o、p两元素的部分电离能数据列于表:
|
元素 |
o |
P |
|
|
电离能/kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子。对此,你的解释是 。
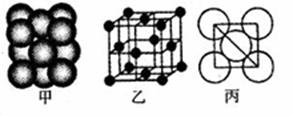
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示,则晶胞中i原子的配位数为 。
(6)元素a、c、e可形成一种相对分子质量为60的一元羧酸分子,其分子中共形成 个 键, 个
键, 个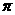 键。
键。
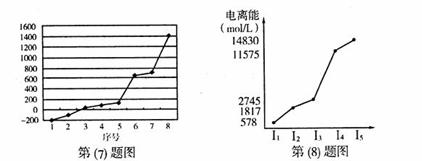
(7)第三周期8种元素按单质熔点高低的顺序如下图,其中电负性最大的是 (填下图中的序号)。
(8)短周期某主族元素M的电离能情况如下图所示,则M元素是述周期表的 元素(填元素符号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com