
题目列表(包括答案和解析)
4.将5.6 g Fe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到20g Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入水中,剩余气体的体积为( )mL
A.1120 B. 2240 C.360 D.4480
3.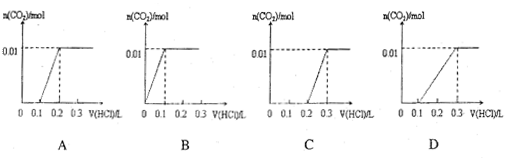 将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
2.下列离子方程式正确的是 ( )
 A.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2+ + 2Br- Cu
+Br2
A.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2+ + 2Br- Cu
+Br2
B.Na2S溶液水解:S2- + 2H2O H2S+2OH-
H2S+2OH-
C.Fe(NO3)3的酸性溶液中通入足量硫化氢:
2Fe3++H2S=2Fe2++S↓+2H+[来源:高&考%资(源#网]
D.H218O中投入Na2O2:
2H218O+2Na2O2=4Na++4OH-+18O2↑
1.稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是( )
A.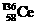 、
、 、
、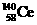 、
、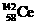 它们互称为同素异形体
它们互称为同素异形体
B.工业上可以采用电解氯化铈水溶液来获得铈单质
C.铈溶于氢碘酸的主要化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑
D.工业上金属铈一般保存在敞口容器中
7.与淀粉相关的物质间转化关系如下图所示。其中B的分子中含有一个甲基,B与羧酸和醇均能发生酯化反应;C的催化氧化产物既是合成酚醛树脂的原料之一,又是常见的居室污染物;E能使Br2的CCl4溶液褪色。


(1)B的结构简式是 。
(2)E→F的化学方程式是 。
(3)某同学欲验证淀粉完全水解的产物A,进行如下实验操作:
①在试管中加入少量淀粉 ②加热3-4 min ③加入少量新制的Cu(OH)2悬浊液 ④加入少量稀硫酸 ⑤加热 ⑥待冷却后,滴加NaOH溶液至溶液呈碱性。
则以上操作步骤正确的顺序是(填选项序号) 。
a.①②④⑤③⑥ b.①④②③⑤⑥ c.①④②⑥③⑤ d.①⑤③④⑥②
2010-2011学年度第一学期
6.合成氨工业对化学和国防工业具有重要意义。
(1)实验室欲用下图所示装置(夹持固定装置略去)制备并收集氨气。
 ① 请在图中烧瓶内绘出导管所缺部分。
① 请在图中烧瓶内绘出导管所缺部分。
② 试管中反应的化学方程式是:
。
③ 为吸收多余的氨气,烧杯中的试剂是 。
(2)氨有很多重要性质。
① 将酚酞溶液滴加到氨水中溶液呈红色,其原因是 。
② 管道工人曾经用浓氨水检验氯气管道是否漏气,如出现白烟,说明有氯气泄露,同时还有一种相对分子质量为28的气体生成,该反应的化学方程式
是 。
5.中学化学中几种常见物质的转化关系如下:(提示:A与硫反应生成低价态)

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
4.如图,将铜片和锌片焊接在一起组成A电极,B为碳棒进行电解实验,电解液中含硝酸银和硝酸铜各0.1 mol。已知电路中通过0.2 mol电子。
(1)请写出A.B两极发生反应的电极反应式A:
 B:
B:
(2)请分析A.B两极质量变化情况为
A:
B: A B
3.现有A、B、C、D、E五种盐溶液,分别由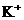 、
、 、
、 、
、 、
、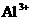 、
、 、
、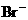 、
、 、
、 、
、 中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同)
中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同)
已知:①A+B→白↓ ②A+D→白↓ ③B+C→白↓
④D+C→白↓ ⑤A溶液中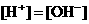
⑥B溶液中 ⑦C、D、E三种溶液的pH<7,
⑦C、D、E三种溶液的pH<7,
根据以上实验事实可以推出(用分子式表示)
A为___________________;B为__________________;
C为___________________;D为__________________;E为___________________.
写出以上①②③④各步反应的离子方程式:
①_________________________________________________________________________
②_________________________________________________________________________
③_________________________________________________________________________
④_________________________________________________________________________
2.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是_____________ ____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com