
题目列表(包括答案和解析)
6.下列说法不正确的是 ( )
A.向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失
B.向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解
C.向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸沉淀全部溶解
D.向MgCl2溶液中滴加NaOH溶液,产生白色沉淀,再加入FeCl3 溶液,沉淀逐渐变为红褐色
5.下列做法正确的是 ( )
A.蒸干FeCl3溶液得到FeCl3固体
B.用稀硝酸除去Cu粉中混有的CuO
C.将工业乙醇蒸馏得到96.5%的乙醇
D.用BaCl2除去NaOH溶液中混有的少量Na2SO4
4.实验室从海带灰中提取碘的操作过程,仪器选用不正确的是 ( )
A.称取3g左右的干海带:托盘天平
B.灼烧干海带至完全变成灰烬:蒸发皿
C.过滤煮沸后的海带灰水混合液:漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘:分液漏斗
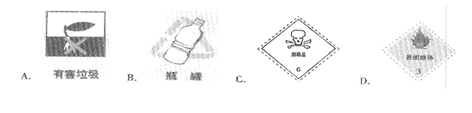
3.以下四种标签,适合贴在无水乙醇试剂瓶上的是
2.下列相关实验不能达到预期目的的是 ( )
|
|
相关实验 |
预期目的 |
|
A. |
相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应 |
探究接触面积对化学反应速率的影响 |
|
B. |
把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 |
探究温度对化学平衡的影响 |
|
C. |
在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热 |
探究蔗糖水解产物具有还原性 |
|
D. |
两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入FeCl3溶液 |
探究FeCl3溶液对H2O2分解速率的影响 |
1.下列能够检验出KI中是否含有Br一的实验是 ( )
A.加入足量的新制氯水,溶液变色则有Br-
B.加入酸性KMn04溶液,观察溶液颜色是否褪去
C.加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br-
D.加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br一
29.(8分)将 氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼热后残留物的质量为
氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼热后残留物的质量为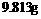 。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为
。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为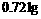 。求原混合物中各化合物质量。
。求原混合物中各化合物质量。
28.(18分)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
二是发生水解促进反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白: 实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是___________________。
实验Ⅱ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是___________________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到溶液最终变黄色,同时观察到的另一现象是______________________。将所得溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为_________________________________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅲ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ、Ⅱ,产生的现象完全相同。由上述实验得出的结论是_________________________________________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是
_____________________ 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是: ①________________________________________________________________; ②________________________________________________________________。
27.(12分)氯化铜晶体(CuCl2•2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
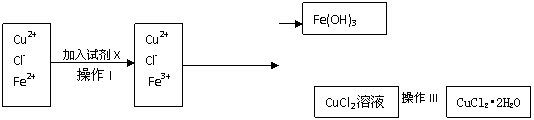
|

 请参照下表给出的数据填空。
请参照下表给出的数据填空。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Cu2+ Fe2+ Fe3+ |
4.7 7.0 1.9 |
6..7 9.0 3.2 |
(1)操作I加入X的目的是 。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项) 。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式) ,并调节溶液的pH在 范围。
(4)操作III的程序依次为 、 、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示); 。
26.(12分)短周期元素形成的纯净物A、B、C、D、E是转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物。
①写出C和H2O反应生成E和D的化学方程式:
。
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系:
。
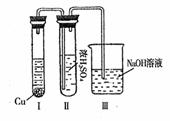 (3)若C是一种气体,D是一种强酸,则:
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
②有人认为“浓H2SO4可以干燥气体C”。某同学
为了验证该观点是否正确,用右图装置进行实验。
实验过程中,浓H2SO4中未发现有气体逸出,且变
为红棕色,则你得出的结论是 。
③已知常温下物质A与物质B生成1mol气体C的焓变为-57.07kJ,1 mol气体C与H2O反应生成D溶液和E气体的焓变为-46kJ,写出物质A与物质B及水生成D溶液的热化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com