
题目列表(包括答案和解析)
3.以下对化学反应知识的归纳和总结中,正确的是 ( )
A.酸跟活泼金属反应一定生成盐和氢气 B.碱能跟一切非金属氧化物反应
C.单质和化合物的反应一定是置换反应 D.置换反应不一定要在溶液中进行
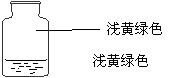
2.向盛有Cl2的三个集气瓶甲、乙、丙中各加入下列液体中的一种,经振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是:
①AgNO3溶液 ②NaOH溶液 ③水 ( )
 |
|||||||||
 |
 |
||||||||
|
|
||||||||
A.①②③ B. ②①③ C.③②① D.①③②
1、下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
|
|
A |
B |
C |
D |
|
强电解质 |
Fe |
NaCl |
CaCO3 |
HNO3 |
|
弱电解质 |
CH3COOH |
NH3 |
H3PO4 |
Fe(OH)3 |
|
非电解质 |
C12H22O11 |
BaSO4 |
C2H5OH |
H2O |
22.(9分)
2 g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075 mol/L KMnO4溶液处理,反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350 mL 0.1 mol/L (NH4)2Fe(SO4)2 溶液完全反应,反应的离子方程式:MnO4- +5Fe2++8H+=Mn2++5 Fe3+ +4H2O
(1) KMnO4溶液与混合物反应,消耗KMnO4的物质的量为 mol。
(2)欲配制500mL 0.1mol/L NH4+ 溶液,需称取 (NH4)2Fe(SO4)2·6H2O (M=392g/mol)
的质量为 g。
(3)混合物中 Cu2S的质量分数为 。
莆田四中2010-2011学年
21.(10分)
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH = ________________.
(2)反应Cl2+Na2SO3+2NaOH = 2NaCl+Na2SO4+H2O中标出电子转移的方向和数目
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl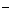 、OH
、OH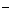 和SO
和SO .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设
假设1:只存在SO32-
假设2:既不存在SO32-也不存在ClO-
假设3:______ _____
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:3moL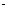 L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
|
实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
 |
|
步骤2:向A试管中滴加1-2滴 溶液 |
若溶液 ,则假设1成立 否则,则假设2或3成立 |
|
步骤3:向B试管中滴加1-2滴 溶液 |
若溶液 ,则假设3成立 否则,结合步骤2中的(2),则假设2成立 |
20.(10分)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1) 写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为 色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20mg-50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若庄KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
19.(8分)
(1)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO42- = BaSO4↓”来表示,请写出有关反应的化学方程式(任写2个)
(2)由稀有气体元素Xe(氙)形成的一种化合物XeO3极不稳定,易转化为单质而显强氧化性。将适量的XeO3投入30 mL Mn2+ 浓度为0.1mol/L的水溶液中,刚好完全反应,放出唯一的气体Xe单质,其在标况下的体积为56 mL,在反应过程中溶液的pH不断减小。
① 已知Mn2+在不同条件下可被氧化为 +4,+6,+7等不同价态,依据题目给出的数据推算氧化产物中锰元素的化合价为
② 若XeO3是分子晶体,试写出有关的离子方程式
18.(7分)
有一澄清溶液其中可能含有NH4+、 K+、 Mg2+、 Ba2+、Al3+、I-、NO3-、CO32-、 SO42-中的几种,取该溶液进行以下实验。
(1)用pH试纸检验,表明溶液呈现强酸性,排除_______的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4呈紫红色,排除_ __的存在。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,滴加过程中和滴加完毕后,均无沉淀产生,则可排除_______的存在。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色溶液生成,证明________存在,又排除________存在。
(5)综上所述,该溶液中上述离子尚不能确定是否存在的是_______
(6)若要确认(5)中相关离子,确认的实验方法是______________。
17.(8分)
 有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH)2溶液、Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均为0.2mol·L-1)。为了鉴别以上物质,操作如下:各取少量溶液进行两两混合,实验现象如表1所示,表中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体,“-”表示观察不到明显现象。
有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH)2溶液、Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均为0.2mol·L-1)。为了鉴别以上物质,操作如下:各取少量溶液进行两两混合,实验现象如表1所示,表中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体,“-”表示观察不到明显现象。
请推测a、b、c、d分别是
a、 b、 c、 d、
16.物质的量之比为2︰5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.1︰4 B.1︰5 C.2︰3 D.2︰5
卷Ⅱ 共52分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com