
题目列表(包括答案和解析)
3、在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N,下列有关说法不正确的的是 ( )
A.该反应的化学方程式为:4NH3+3F2=== NF3+3NH4F
B.M是极性分子,其氧化性比F2弱
C.M既是氧化产物,又是还原产物
D.4molNH3参加反应失去12mol电子
2、含HS-的溶液中,能大量共存的离子组 ( )
A.K+、Fe3+、SO42-、Cl- B.Na+、Al3+、NO3-、Cl-
C.S2-、SO32-、Na+、K+ D.Ca2+、K+、SO42-、NO3-
1、2008年初,我国部分地区出现了罕见的持续低温冰冻的极端天气,这是建国以来最为严重的一次雪凝天气灾害。造成电力设施严重受损、路面结冰交通瘫痪等,给人们的生产、生活造成极大的影响。下列说法正确的是 ( )
A.因为水分子之间可以形成较强的化学键--氢键,所以易造成雪凝和冻雨现象。
B.因为雨从天空落下时是低于0℃的过冷水滴,所以与地面物体相碰立刻冻结。
C.因为冰的密度比水大,所以附着在输电设施上的冰柱使线路断线、塔杆倒塌。
D.因为水是非电解质,所以电路维修工冒雨雪上杆塔除冰柱无触电的危险。
30. (10分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
(10分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
www.k@s@5@ 高#考#资#源#网
(1)若反应①、②、③均为溶液中的置换反应,A、D、E为第ⅦA族元素单质。则A、D、E的氧化性由强到弱的顺序为(用化学式表示)________________________。
(2)若B是某元素R的氢化物,B的沸点大于与其同主族的其他元素氢化物的沸点,且B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应①的化学方程式___________________,③的化学方程式______________。
(3)若B由短周期元素X、Y组成,且X、Y原子个数比为1∶1,B晶体中既含离子键,又含非极性共价键;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,反应①的离子方程式_____________________________。
29.(16分)资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
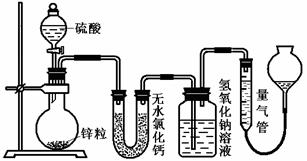
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ (选填:200,400,500) mL 。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:________________________________________
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到 VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意: 、 、 。
28.(14分) 甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如右图。请回答:
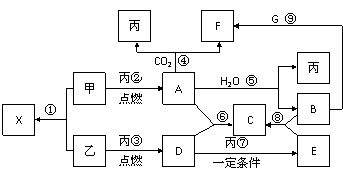
(1)写化学式:丙_____ E________
(2)X的电子式为_____________。
(3)写出反应⑥的化学反应方程式: 。
(4)写出B与G溶液反应生成F的离子方程式: 。
(5)在上图的反应中,不属于氧化还原反应的是(填序号)____________________。
(6)将8 g 乙在足量丙中燃烧,所得气体D通入100mL 3.5mol·L-1的B溶液中,完全吸收后,溶液中的溶质及其物质的量分别为 ;若同体积的气体D通入100mL 2.5mol·L-1的B溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序为 。
27.(10分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
① 用蓝色石蕊试纸检测该溶液,试纸显红色;
② 取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③ 取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④ 取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤ 取实验 ④ 后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
⑴用简要语言描述在实验 ① 中的操作
⑵根据上述实验判断原溶液中肯定存在的离子是______________,肯定不存在的离子是__________。
⑶写出与②③两个实验有关的离子方程式:
②___________________________ ③_________________________
26.(10分)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,
已知:As是产物之一。
(1)写出并配平该反应的化学方程式 ;
(2)在该反应中,得电子的物质是 ,被氧化的元素是 ;
(3)在反应中,每转移1 mol电子,消耗(或生成)HCl mol;
(4)下列叙述正确的是 (填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.在相同条件下,还原性顺序:S2->I->Fe2+>Br->Cl-
19、(16分)
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的两元素化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为 ,W3分子空间构型为 ;
(2)X单质与水发生主要反应的化学方程式为 ;
(3)化合物M的化学式为 ,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是 。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有 ,O-C-O的键角约为 ;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z= ;
(5)含有元素Z的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。
18、(10分)第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A与B的次外层电子数为8,而C与D次外层电子数为18,根据结构填空:
(1)写出元素名称:A ,B ,C ,D 。
(2)D的简单离子是 。
(3)元素的氢氧化物碱性最强的是 。
(4)B与D二原子间能形成化合物的化学式是 。
(5)写出A、B的电离能顺序 。
(6)写出C基态原子的电子排布式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com