
题目列表(包括答案和解析)
3.下列实验现象的描述错误的是.w.^w.k.&s.5*.高.考.资.源.网
A.氢气在氯气中燃烧生成白色烟雾
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C.红热的铜丝在氯气中燃烧,产生棕黄色烟
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
1. 清蒸大闸蟹由青色变成红色,一同学认为这种红色物质可能象酸碱指示剂一样,遇到酸或碱颜色会发生改变。就这位同学的看法而言,这应该属于科学探究中的
A.实验 B.假设 C.观察 D.分类
2.下列有关氧化还原反应的叙述中正确的是
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原反应的本质是元素化合价的升降
C.金属单质在化学反应中一定作还原剂
D.失电子的反应物在反应中作还原剂,生成还原产物
21、(10分)U、V、W、X、Y、Z是由周期表中短周期元素组成的6种物质,其中Z是一种单质;V、W、Y均由两种元素组成,U、X由三种元素组成,上述6种化合物涉及的所有元素中有三种元素位于第三周期,且所有元素的原子序数之和等于52。它们之间的反应关系(反应条件省略,方程式没有配平):
①W+H2O→X(白色沉淀)+Y(气体)
②V+NaOH溶液→U+Y(气体)
③Y+O2→Z(无色无味气体)+H2O
⑴写出下列物质的化学式:X、 Y、 V
⑵完成下列化学反应方程式:
①
②
20、(13分)草木灰主要含有K2CO3,还含有K2SO4和KCl。现拟从草木灰中提取钾盐晶体,并测定K2CO3的含量。
⑴提取钾盐晶体主要步骤为:A溶解,B蒸发结晶,C过滤,D洗涤。
①正确的操作顺序是:
②实验中共有几步操作使用了玻璃棒? 其中操作C中玻璃棒的作用是: 。
③操作D的目的是 。
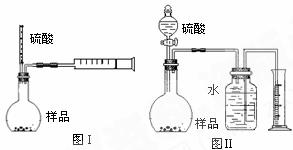 ⑵为测定所得晶体中所含K2CO3的质量分数,拟分别采用如图(Ⅰ)、(Ⅱ)所示装置来测定,试回答下列问题。
⑵为测定所得晶体中所含K2CO3的质量分数,拟分别采用如图(Ⅰ)、(Ⅱ)所示装置来测定,试回答下列问题。
①装置 造成误差较大,应如何改进
②检查图(Ⅰ)装置气密性的方法为
③有人提出将图(Ⅰ)装置中量气装置去掉,再把烧瓶换成试管,反应后也能较准确地测出样品中K2CO3的质量分数,请你分析此方案中,除称得样品的质量为m,还需测定的两个数据是: 。
19、 (9分)A-F都是中学化学常见物质,它们间的相互转化关系如下图所示,其中A、D、F是化合物,E是非金属单质。
(9分)A-F都是中学化学常见物质,它们间的相互转化关系如下图所示,其中A、D、F是化合物,E是非金属单质。
⑴若B、C都是非金属单质,则B、C、E三者的氧化性由强到弱的顺序是:
⑵若B是金属单质,C是非金属单质,则E的分子式是 ,反应②的化学方程式是
⑶ 若B、C都是化合物,则E的分子式是 ,反应①中每生成1molE转移电子的物质的量是 ,反应的离子方程式是: 。
18、(7分)A、B、C、D、E均为可溶于水的固体,组成它们的离子可能有:
Na+、Ca2+、Ba2+、ClO-、HSO4-、CO32-、Cl-。
分别取它们的溶液进行实验,主要操作及现象如下:
①向A的溶液中通入二氧化碳,再加入品红溶液,红色褪去。
②将B和C的溶液混合,生成白色沉淀,该沉淀可溶于E溶液。
③将B和D的溶液混合,生成白色沉淀,继续加入过量的E溶液,有气泡产生的同时还有白色沉淀存在。
④A和E溶液的焰色反应都呈黄色。
⑴写出下列物质的化学式:A、 C、 D、
⑵写出A-E溶液中,与铝发生置换反应的离子方程式为
⑶向B的溶液中,缓缓滴入少量稀的E溶液,其主要的离子方程式为
17、(13分)黄铜矿(主要成分为CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
⑴冶炼铜的有关反应为:8CuFeS2+21O2== 8Cu+4FeO+2Fe2O3+16SO2。
已知在CuFeS2中Fe的化合价为+2,则该冶炼铜的反应中被氧化的元素是 [来源:]
(填元素符号)
⑵上述冶炼过程中会产生大量的SO2。下列处理方案中不合理的是
(填字母代号)
A.高空排放 B.用于制备硫酸
C.用纯碱溶液吸收制取Na2SO3 D.用浓硫吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2,有关离子方程式为:
S2O82-+2I-==2SO42-+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。Fe3+对上述反应的催化过程(Fe3+参与反应)用离子方程式可表示为 。
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:a.用稀盐酸浸取炉渣,过滤;b.滤液先经过氧化,再加入过量的NaOH溶液,反应后过滤;c.将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
① b中除去Al3+的有关反应的离子方程式为: [来源:]
② 2.3g黄铜矿(含CuFeS280%)理论上可制得Fe2O3 g。
16、一些烷烃的燃烧热如下表:
|
化合物 |
燃烧热/KJ·mol-1 |
化合物 |
燃烧热/KJ·mol-1 |
|
甲烷 |
891.0 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
下列表达正确的是 ( )
A.正戊烷的燃烧热大约在3540kJ·mol-1左右
B.热稳定性:正丁烷>异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=== 4CO2(g)+6H2O(g)
ΔH=-1560.8KJ/mol
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
第Ⅱ卷(非选择题,共52分)
15、在标准状况下,mgA气体与ngB气体分子数相等,下列说法不正确的是: ( )
A.标准状况下,同体积的气体A和气体B的质量比m∶n
B.25℃时,1Kg气体A与1Kg气体B的分子数之比为n∶m
C.同温同压下,气体A与气体B的密度之比为n∶m
D.标准状况下,等质量的A与B的体积比为m∶n
14、等质量的单质A和化合物B分别和足量水反应生产C、D两种气体单质,一定条件下,产生的C和D两种气体单质恰好可完全反应,则下列判断中正确的是 ( )
A.A和B的摩尔质量相同
B.组成A、B的元素均为短周期元素
C.等质量的A和B所含的质子数相同
D.等物质的量的A和B与足量水反应产生的气体体积比为(同温同压下)为2∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com