
题目列表(包括答案和解析)
5.已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
A.0.01mol·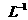 的蔗糖溶液
B. 0.01mol·
的蔗糖溶液
B. 0.01mol·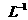 的
的 溶液
溶液
C.0.02mol·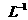 的
的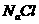 溶液
D. 0.02mol·
溶液
D. 0.02mol·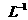 的
的 溶液
溶液
4.下列说法正确的是
A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相等
3.化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.  的熔点很高,可用于制作耐高温材料
的熔点很高,可用于制作耐高温材料
D. 电解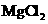 饱和溶液,可制得金属镁
饱和溶液,可制得金属镁
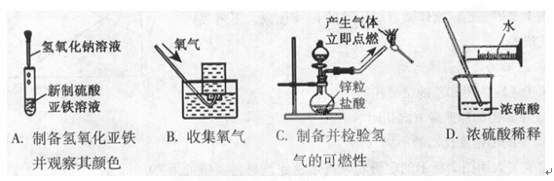
2.下列实验能达到实验目的且符合安全要求的是
1.下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
17. (12分)
钠是一种很活泼的金属,在工业上常用电解熔融NaCl的方法制得,其另一产物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解方法制取钠的化学方程式 。
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是 。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
①提出合理假设。
假设1:该漂白粉未变质,只含 ;
假设2:该漂白粉全部变质,只含 ;
假设3:该漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3。
② 设计实验方案,进行实验。请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
|
实验步骤 |
预期现象和结论 |
|
|
① |
取少量上述漂白粉于试管中, |
|
|
② |
|
|
|
③ |
|
|
2011届高三第一次六校联考
16. (12分)
实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。


(1)过滤时需要用到的玻璃仪器是 。
(2)检验加入BaCl2溶液后SO42-是否沉淀完全的操作为 。
(3)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由 。
(4)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液。
他的思路如下:
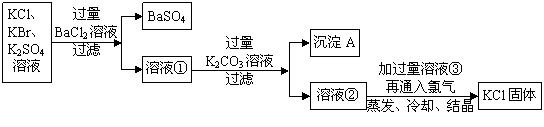

沉淀A的化学式是 ,溶液③中的溶质是 。
15. (12分)
现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白。
(1)实验室里,可用于吸收SO2尾气的一种试剂是 。
(2)高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、 FeO、SiO2)为原料制备高纯氧化铁(软磁α- Fe2O3)的生产流程示意图:


①步骤I中过滤所得滤渣的主要成分是 。
②步骤II中加入铁粉的目的是 。
③步骤Ⅲ中可选用 试剂调节溶液的pH(填标号)。
A.稀硝酸 B.双氧水 C.氨水 D.高锰酸钾溶液
④写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式 。
⑤从滤液C中回收的主要物质的一种用途是 。
14. (13分)
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g)  CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g)  CH3OH(g) △H2
CH3OH(g) △H2
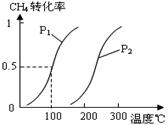
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
(1)温度不变,缩小体积,增大压强,①的反应速率 (填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)反应①的△H1 0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是 。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
|
实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
|
I |
150 |
1/3 |
0.1 |
|
II |
|
|
5 |
|
III |
350 |
|
5 |
13. (12分)
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
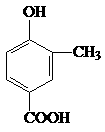
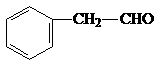
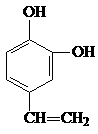
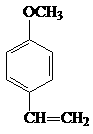
A B C D
(1)A中的含氧官能团名称是 。
(2)B与足量氢气充分反应的产物的结构简式为 。
(3)D发生聚合反应的产物的结构简式为 。
(4)A能与乙醇发生反应生成一种有特殊香味的物质,请写出该反应的方程式:
。
(5)关于上述四种物质的说法中正确的是 。
A.都能与Na反应放出H2
B.C、D均能使溴的四氯化碳溶液褪色
C.A和C均能与NaHCO3溶液反应放出CO2
D.1molC最多能与4molBr2发生反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com