
题目列表(包括答案和解析)
17、 已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
A.该装置中Cu极为正极
B.当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C.b极反应的电极反应式为:H2-2e-=2H+
D.一段时间后锌片质量减少
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
A.该装置中Cu极为正极
B.当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C.b极反应的电极反应式为:H2-2e-=2H+
D.一段时间后锌片质量减少
第Ⅱ卷非选择题 (49分)
16、V L Fe2(SO4)3溶液中含Fe3+m g,溶液中SO2-4的物质的量浓度是


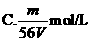

14、下列关于阿伏加德罗常数NA的说法正确的是 ( )
A.铜与热的浓H2SO4反应放出l mol气体时转移的电子数为2NA
 B.1mol冰中含有的氢键数目为NA
B.1mol冰中含有的氢键数目为NA
C.标准状况下,22.4 L CCl4含有的分子数为NA
D.1 mol羟基含有的电子数为7NA
15如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来( )
A.增大 B.减小 C.不变 D. 无法确定
13、一定体积0.01mol/L的稀硝酸溶液恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01mol/L的NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸溶液的1/5,则样品中铁、铝的物质的量之比为 A.2:3 B.1:3 C.1:4 D.5:3
12、己知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的△H= -55.6kJ/mol。则HCN在水溶液中电离的△H等于 A.-67.7 kJ/mol B.-43.5 kJ/mol C.+43.5 kJ/mol D.+67.7kJ/mol
11、把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 A.0.1(b-2a)mol/L B.10( 2a-b)mol/L C.10(b-a)mol/L D.10(b-2a)mol/L
10、下列离子方程式书写正确的是 A.向明矾溶液中加入过量的氢氧化钡溶液: Al3+ + 2SO42-+2Ba2+ + 4OH-= 2BaSO4↓+ AlO2-+ 2H2O B.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2 + 2H+ = Fe2+ + 2H2O C.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4+ + OH-= NH3∙H2O D.澄清石灰水与过量小苏打溶液混合:Ca2+十OH-+HCO3--= CaCO3↓+H2O
9、下列哪种情况能使下图装置中的溶液导电性呈现“强-弱-强”变化的是()
 A.将100mL 0.1mol/L的H2SO4溶液慢慢加入50mL 0.1mol/L的Ba(OH)2溶液中;
A.将100mL 0.1mol/L的H2SO4溶液慢慢加入50mL 0.1mol/L的Ba(OH)2溶液中;
B.将50mL 0.1mol/L的NaCl溶液慢慢加入50mL 0.1mol/L的AgNO3溶液中;
C.在50mL Na2SiO3溶液中通入CO2直至过量;
D.在50mL 0.1mol/L的CH3COOH溶液中慢慢加入50mL 0.1mol/L的 NaOH溶液
8、工业上生产MnO2和Zn的主要反应有
①MnO2 + ZnS + 2H2SO4
= MnSO4 + ZnSO4 + S + 2H2O
②MnSO4 + ZnSO4 + 2H2O MnO2
+ Zn + 2H2SO4
下列说法不正确的是
A.①中MnO2和H2SO4都是氧化剂 B.①中析出16gS时转移1 mol电子
C.②中MnSO4发生氧化反应
D.硫酸在该生产中可循环使用
MnO2
+ Zn + 2H2SO4
下列说法不正确的是
A.①中MnO2和H2SO4都是氧化剂 B.①中析出16gS时转移1 mol电子
C.②中MnSO4发生氧化反应
D.硫酸在该生产中可循环使用
7、常温下,下列各组离子在指定溶液中能大量共存的是 A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ B.由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- C.c(H+)/ c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com