
题目列表(包括答案和解析)
21. (10分)
簸箩酯是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸(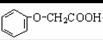 )
)
发生酯化反应的产物。
(1)5.8g甲完全燃烧可产生0.3mol CO2和0.3molH2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构。由甲在一定条件下加聚可得一种重要的高分子,写出该反应的方程式_______________________________________________,所得高分子中的官能团名称是___________________。
(2)苯氧乙酸有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上一硝基取代物有2种的同分异构体分别是 。
(3)已知: ,
,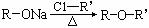 (R-、
(R-、 代表烃基) 簸箩酯的合成线路如下:
代表烃基) 簸箩酯的合成线路如下:
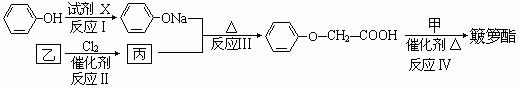
①试剂X不可选用的是(选填字母) 。
a.Na b.NaOH溶液 c.NaHCO3溶液
②丙的结构简式是 。
③反应Ⅳ的化学方程式是 。
20.(11分)
(Ⅰ)(3分)化学与生活、社会密切相关,下列说法正确的是( )
A.维生素在天然食品中含量丰富,所以加工后的食品中维生素的含量也高
B.2M+N=2P+2Q ,2P+M=Q(M、N为原料,Q为期望产品)符合“绿色化学”的要求
C. 世界卫生组织建议成人每天钠的摄取量少于2000 mg,即成人每天可摄取少于2000 mg的食盐
D.铁是人体必须微量元素中含量最多的一种,体内缺铁会引起贫血
E.高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3。该反应的离子方程式为:
2Fe(OH)3+3ClO-+4OH-==2FeO42-+3Cl-+5H2O
F.在人类必须的三大营养素:糖类、油酯、蛋白质中,糖类是热能最高的营养素
(Ⅱ)(8分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,实验步骤如下图所示。
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是 。
(2)步骤②加入过量H2O2的目的: 。
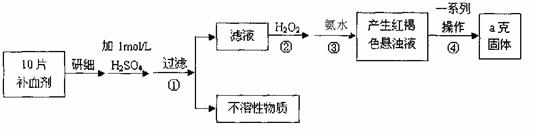
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
① 实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除药匙、天平(附砝码)、玻棒、烧杯、胶头滴管外,还需 。②滴定到终点时的颜色为 色。
(6)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天需服用含 mgFeSO4·7H2O片剂。
19.(9分)某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。查阅资料显示:溴水是溴(Br2)的水溶液,呈黄色;溴水中含有溴单质。
⑴提出问题:Fe3+、Br2谁的氧化性更强。
⑵猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含 (填化学式,下同)所致;
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致。
⑶设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
除氯化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
⑷结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为
⑸实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 (填离子的化学式)。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
18.(12分)工业上制备BaCl2的工艺流程图如下:
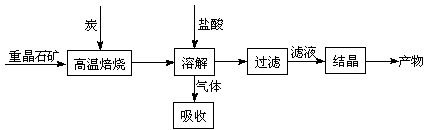
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 =
+571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =
+571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= +226.2 kJ·mol-1 ②
(1)用盐酸溶解时产生的有毒气体可用过量的NaOH溶液进行吸收,写出其离子方程式 。
(2)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
, 。
(3)反应C(s) + CO2(g) 2CO(g)的△H = 。
2CO(g)的△H = 。
(4)取一定量的产物配成100mL 1mol·L-1的溶液,取其中的5mL,加入5mL 1mol·L-1的AgNO3溶液,充分反应后,生成沉淀的质量为 g,此时溶液中c(Ag+)为 。[Ksp(AgCl)=2.0×10-10,忽略溶液混合时的体积变化]
17.(10分) X、Y、Z分别是三种常见单质,Y是一种轻金属。M、N、R是常见的三种氧化物,其中R具有较高熔点,它们有如下反应关系(条件未标出,方程式未配平):
①X+Z→M ②M+X→N ③M+Y→R+X
(1)组成X单质的元素在元素周期表中的位置是 ,比较Y和Z元素原子形成的单原子离子半径大小 (用其离子符号表示)
(2)写出反应③的化学反应方程式
(3)已知6克X在常温常压下完全燃烧生成M时所放出的热量为196.75KJ,请写出X的燃烧热的热化学方程式
(4) 用化学方程式表示出N的一种工业用途 ______
16.将17.9g Al、Fe、Cu组成的合金溶于足量的:NaOH溶液中,产生气体3.36L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,生成6.72L NO(标况),向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为
A.33.2g B.25.4g C.22.4g D.19.6g
15.下列关于实验仪器的使用说法错误的是
A.分液漏斗、容量瓶、滴定管使用前需要检查是否漏水
B.在强酸与强碱中和滴定实验中,无论是酸滴定碱还是碱滴定酸,都可以测出待测液的物质的量浓度
C.烧杯、圆底烧瓶、蒸发皿都可以直接用来加热
D.使用容量瓶配制溶液,在定容时仰视会使所配制的溶液浓度偏低
14.下列物质不能用来鉴别乙酸、乙醇、苯的是
A.碳酸氢钠溶液 B.紫色石蕊溶液
C.溴水 D.酸性高锰酸钾溶液
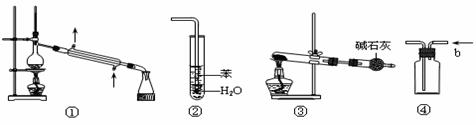
13.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4Cl为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气,可收集H2、NH3等气体
12. N2O5是一种新型硝化剂,某温度下有反应:2N2O5(g) 4NO2(g)+O2(g) △H>0,下表为T1温度下的部分实验数据:
N2O5是一种新型硝化剂,某温度下有反应:2N2O5(g) 4NO2(g)+O2(g) △H>0,下表为T1温度下的部分实验数据:
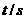 |
0 |
500 |
1000 |
1500 |
|
C(N2O5)mol/L |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是
A.Tl温度下的平衡常数为Kl=125
B.500s内N2O5分解速率为2.96×10-3mol/(L·s)
C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
 D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3.则T1>T3
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3.则T1>T3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com