
题目列表(包括答案和解析)
6.有A、B、C、D四种金属。将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈。将铜浸入B的盐溶液中,无明显变化。如果把铜浸入C的盐溶液中,有金属C析出。据此判断它们的活动性由强到弱的顺序
A. DCAB B. DABC C. DBAC D. BADC
5.下列各组离子能大量共存且溶液颜色为无色的是
A.Na+、MnO4-、K+、NO3-、SO32- B.Na+、S2-、CO32-、OH-、NO3-
C.Na+、S2-、H+、K+、Cl-、NO3- D.Fe2+、H+、Na+、Ca2+、NO3-
4.对溶液中的离子反应,有以下的说法:①不可能是氧化还原反应,②一般都是可逆反应,
③只是复分解反应,④有可能是置换反应,⑤不可能有分子参加。其中正确的是
A.①③ B.只有④ C.④⑤ D.②④
3.在室温下,等体积的酸和碱的溶液混合后,pH一定少于7的是
A.pH=3的HNO3跟pH=11的KOH B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的NaOH D.pH=3的醋酸跟pH=11的Ba(OH)2
2.在已达到电离平衡的0.1 mol/L的醋酸溶液中,欲使平衡向电离的方向移动,
同时使溶液的pH 降低,应采取的措施是
A.加少量盐酸 B.加热 C.加少量醋酸钠晶体 D.加氢氧化钠
1.下列溶液一定是碱性的是
A.pH=8的某电解质的溶液 B.c(OH-)>1×10-7mol/L
C.溶液中含有OH- D.溶液中c(OH-)>c(H+)
21.(12分)在一定温度下,向一个容积不变的密闭容器中加入 2 molA
和 2 molB
,发生反应:2A(g) + B(g) 3C(
g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
3C(
g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
(1)该反应平衡常数K表达式为________________________。 a与b的关系是a b(填“>”、“<”、“=”)。
(2)若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”,下同),达到平衡时B的体积分数_________。
(3)下列说法中能表明该反应已达到平衡状态的是_________。
A.温度和体积一定时,容器内压强不再变化
B.温度和体积一定时,某一物质浓度不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)若向上述平衡体系中再充入1 molB 和3 molC,在相同条件下达到平衡时B的体积分数为ω2 %,则ω1% ω2 % (填“>”、“ =”或“<”),理由是 。
江西吉安一中2010-2011学年上学期高三开学模拟考试
20.(12分)高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:

试回答下列问题
(1)操作①搅拌的目的是: 。
(2) 操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _______________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)
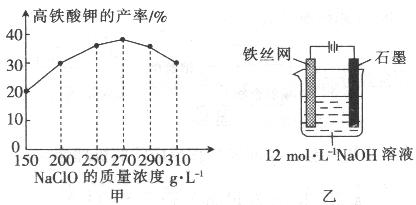
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为 。
19. (9分) 已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它会自动脱去一分子水生成含有羰基的化合物。化合物A为苯的同系物,aLA的蒸汽完全燃烧消耗相同状况下O2 9aL。关于A的一系列转化关系如图所示。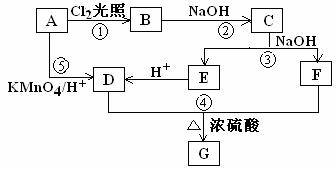
其中C能发生银镜反应,并且C在浓碱条件下可以发生自身氧化还原反应生成E和F。回答有关问题
(1)反应①②③④⑤中,不属于取代反应的有___________________(填序号)。
(2)B是反应①的产物之一,写出反应①的其他可能产物中摩尔质量为195.5g/mol的结构简式__________________。
(3)写出反应④的化学方程式_____________________________________。
(4)G属于芳香酸苯酚酯类的同分异构体有______种,写出其中任意一种的结构简式____________。
18. (10分)2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ·mol-1(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为
①
②N2 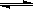 N2吸
N2吸 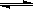 2N
2N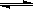 2N吸
2N吸
③N吸+H吸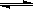 NH吸
NH吸
④NH吸+H吸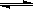 NH2吸
NH2吸
⑤NH2吸+H吸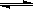 NH3吸
NH3吸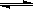 NH3
NH3
(2)T=673K,合成氨反应的热化学方程式为 。
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3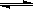
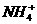 +
+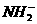 (某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com