
题目列表(包括答案和解析)
5.下列叙述错误的是
A.氨与酸反应生成铵盐 B.氨气与氯化氢气体相遇产生白烟
C.氨水中滴入酚酞溶液显红色 D.氨使湿润的蓝色石蕊试纸变红
4.将CO2,NO2,NO,SO2分别通过NaOH溶液,不能被吸收的气体
A.NO2 B.NO C.CO2 D.SO2
3.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有
A. ①③④⑤ B.全部 C. ①②⑥ D.②③⑥
2.下列气体中,直接排放到大气而不会产生污染的是
A NO B O3 C CH4 D CO2
1.亚碘酸钠的化学式为
A NaI B NaIO C NaIO2 D NaIO3
20.(12分)利用从冬青中提取出的有机物A合成抗结肠炎药物Y及其他化学品,合成路线如下图:
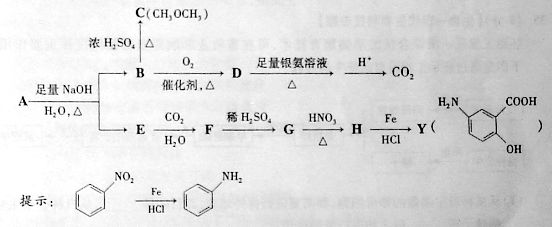
根据上述信息回答:
(1)D不与NaHC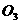 溶液反应,D中官能团的名称是____ __,B
溶液反应,D中官能团的名称是____ __,B C的反应类型是___
_。
C的反应类型是___
_。
(2)写出A生成B和E的化学反应方程式__ ____。K^S*5U.C#O%下
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生产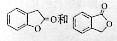 ,鉴别I和J的试剂为__
___。
,鉴别I和J的试剂为__
___。
(4)A的另一种同分异构体K用于合成高分子材料,K可由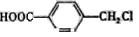 制得,写出K在浓硫酸作用下生成的聚合物的结构简式__________ _____。
制得,写出K在浓硫酸作用下生成的聚合物的结构简式__________ _____。
19.(12分)锂离子电池的广泛应用使回收利用锂货源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
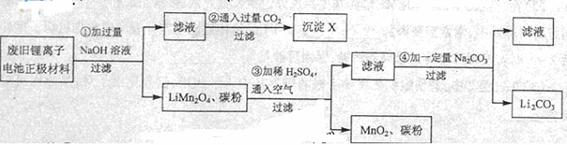
(1)第②步反应得到的沉淀X的化学式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有 。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
、 。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g第③步反应中加入20.0mL3.0mol·L-1的H2SO4溶液。假定正极材料中的锂经反应③和④完全为Li2CO3,则至少有 gNa2CO3参加了反应。
18.(14分)硫-碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2===H2SO4+2HI
 II 2HI H2+I2
II 2HI H2+I2
III 2H2SO4====2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
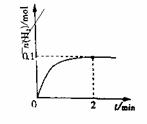 (2)一定温度下,向1L密闭容器中加入1molHI(g),
(2)一定温度下,向1L密闭容器中加入1molHI(g),
发生反应II,H2物质的量随时间的变化如图所示。
0~2min内的平均反应速率v(HI)= 。
 该温度下,H2(g)+I2(g)
2HI(g)的平衡
该温度下,H2(g)+I2(g)
2HI(g)的平衡
常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
17.(14分)由短周期元素组成的化合物X是某抗酸药的有效成分。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。
(1)Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是__________。
(2)由Ⅰ、Ⅱ判断X一定不含有的元素是磷、_____________。
(3)Ⅲ中生成B的离子方程式是_____ ________。
(4)Ⅳ中B溶解的离子方程式是______ _______。
(5)沉淀C的化学式是_____________。
(6)若上述n(A):n(B):n(C)=1:1:3,则X的化学式是_____________。
16.把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.mol·L-1 B. mol·L-1 C. mol·L-1 D. mol·L-1
第II卷(非选择题 共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com