
题目列表(包括答案和解析)
6.下列离子方程式正确的是:
A.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O
5.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是 ( )
(已知:氧化性Fe2+<Ni2+<Cu2+)www.k@s@5@ 高#考#资#源#网
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
4.将用导线连接的锌片和铜片插入盛有稀H2SO4的烧杯中,下列叙述正确的是
A.正极有O2逸出 B.硫酸溶液的pH增大
C.电子通过导线由铜片流向锌片 D.锌片上有H2逸出
3..电解100mL含 c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是
A. 0.10mol/LAg+ B. 0.20mol/L Zn2+
C. 0.20mol/L Cu2+ D. 0.20mol/L Pb2+
2.下列化合物,按其晶体的熔点由高到低排列正确的是
A.SiO2 CaCl CBr4 CF2 B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2
1..下列说法正确的是 ( )
A.明矾和漂白粉常用于水处理,两者的作用原理相同
B.18g冰比18g水中的氢键多
C.工业生产中常用焦炭等还原剂从氧化铝中获取铝
D.电解精炼铜时,当转移NA个电子时,阳极材料质量一定减轻32g
20.(6分)已知Cl2在70℃的NaOH溶液中,能同时发生两个反应:
Cl2 + 2NaOH = NaCl + NaClO + H2O;3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
反应完后,测得溶液中NaClO和NaClO3的物质的量之比为4∶1。现有49.7g Cl2,将其通入到足量的70℃的NaOH溶液中,充分反应后得500mL溶液。计算完全反应后各生成物的物质的量浓度(不计算水的量)。
2010-2011学年度暑期补课阶段考试高三试题
19、(12分)已知有以下物质相互转化
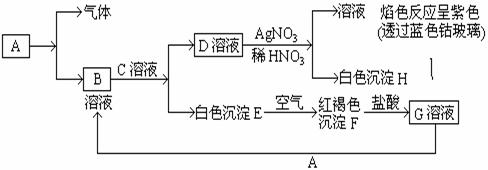
试回答:
(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)检验G溶液中阳离子存在的试剂是_____________________。证明存在的现象是 。向G溶液加入A的有关离子反应方程式 _____________________________________________。
18、(9分)有一包白色固体,可能含有NaCl、Na2SO4、CaCl2、CuSO4、Na2CO3 和CaCO3 ,将固体放入水中,经搅拌后变为无色溶液,在溶液里加入BaCl2 溶液,产生白色沉淀,再加入盐酸,沉淀全部消失并有气体放出,由此推断: (1)原固体肯定有______________。
(2)原固体肯定不存在 。
(3)____________不能确定存在与否,要确定其存在,应进行的实验是___
。
17. (9分)已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为: ,它的共价键属于 (填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为 。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:___________________ ______ ;
X与W形成的化合物与水反应时,水作的是 (填:氧化剂、还原剂)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com