
题目列表(包括答案和解析)
16、现有25℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中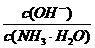 (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式 ;所得溶液的pH____7(填“>”、“<”或“=”),用离子方程式表示其原因 ;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)= a mol/l,则c(SO42-)= ;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是 。
15、( )常温时,将V1mL c1 mol/L的醋酸滴加到V2mL c2 mol/L的烧碱溶液中,下列结论正确的是
A.若V1=V2,且混合溶液pH<7,则必有c1<c2
B.若V1=V2,c1=c2,则混合溶液中c(OH-)=c(CH3COOH)+ c(H+)
C.若混合溶液的pH>7,则混合溶液中c(Na+) <c(CH3COO-)
D.若混合溶液的pH=7,则混合溶液中c(Na+)=c(CH3COO-)+c(CH3COOH)
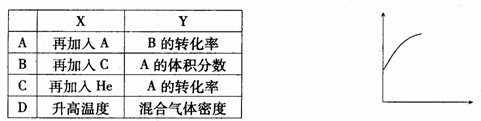
14、( )在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g) 2C(g);△H<0。达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);△H<0。达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
13、( )用二根铂丝作电极插入KOH溶液中,分别向两极通人甲烷和氧气,可作为一种燃料电池的模拟装置。试判断下列说法正确的是
A.通氧气的铂极为负极 B.此电池反应为CH4+2O2=CO2+2H2O
C.此电池放电时,KOH浓度减小 D.此电池放电时,KOH浓度不变
12、( )已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
根据上述电离常数分析,下列表述不正确的是
A.25℃时,等物质的量浓度的各溶液pH关系为:
pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中
c(Na+)=c(CN-),则a一定大于b
C.2 NaCN + H2O + CO2 =2 H CN + Na2 CO 3
D.2C H3C O O H + Na2CO3 → 2 C H 3C O O Na + H2O + CO2 ↑
11、( )下列有关用水杨酸和乙酸酐制备阿司匹林(乙酰水杨酸)的说法中不正确的是
A. 属取代反应
属取代反应
B.为除去阿司匹林中混有的杂质,可在粗产品中加足量NaHCO3溶液、搅拌、过滤、洗涤沉淀,再在所得滤液中加足量盐酸、冷却结晶、过滤、洗涤、干燥即得精品
C.可用FeCl3溶液检验阿司匹林中是否含有未反应完的水杨酸
D.一定条件下,1mol阿司匹林最多可与2mol的NaOH反应
10、( )某学生用量筒量取液体,初次视线与量筒内凹液面的最低处保持水平,读数为9.8mL。倒出部分液体后,俯视凹液面的最低处,读数为3.5mL,则该学生实际倒出液体的体积
A.大于6.3mL B.小于6.3mL C.等于6.3mL D.无法确定
9、( )减压吸滤装置和普通的过滤装置相比,除可加快过滤速度外,还具有的优点是
A.可过滤胶状沉淀 B.可过滤颗粒更小的沉淀
C.可使沉淀中的杂质减少 D.可得到较干燥的沉淀
8、(
)早在1807年化学家戴维用电解熔融氢氧化钠制得钠4NaOH(熔)  4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
3Fe+4NaOH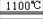 Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
B.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
C.盖·吕萨克法制钠原理是利用铁的还原性比钠强
D.目前工业上常用电解熔融氯化钠法制钠,电解槽中石墨极为阳极,铁为阴极
7、( )在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应

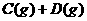 已达平衡的是
已达平衡的是
A.混合气体的压强 B.混合气体的平均分子量
C.A的物质的量浓度 D.气体的总物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com