
题目列表(包括答案和解析)
4.卫生部下发紧急通知要求查处苏丹红“红心鸭蛋”。被查处的所谓“红心鸭蛋”是有人将工业染料“苏丹红4号”非法用作饲料添加剂,使得某些“红心鸭蛋”中含有对人体有害的苏丹红。“苏丹 红4号”的结构简式为: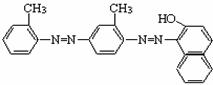
下列关于“苏丹红4号”说法中错误的是
(A)能发生加成反应 (B)分子式为C24H20N4O
(C)能被酸性高锰酸钾溶液氧化 (D)属于苯的同系物
3.25℃时,在pH=13的溶液中可以大量共存的离子组是
(A)K+、Na+、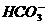 、
、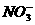 (B)Na+、K+、
(B)Na+、K+、 、Cl-
、Cl-
(C)H+、Mg2+、 、
、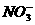 (D)Ag+、K+、
(D)Ag+、K+、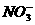 、Na+
、Na+
2.用NA表示阿伏加德罗常数,下列说法正确的是
A.0.2 mol过氧化氢完全分解转移的电子数目为0.4NA
B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
C.在常温常压下,17 g硫化氢所含质子数目为8 NA
D.在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA
1.下列说法正确的是
A.大量使用含磷洗涤剂会带来白色污染
B.减少使用氟氯代烷的目的是为了减少酸雨
C.硫酸厂不应建在人口稠密的居民区和环保要求高的地区
D.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
29.(15分)(1)在100 mL浓度为1mol•Lˉ1的明矾[KAl(SO4)2•12H2O]溶液中,加入
▲ mL 1mol•Lˉ1的氢氧化钡溶液,能使产生的沉淀中Al(OH)3质量最多。当加入过量的1mol•Lˉ1的氢氧化钡溶液后,产生的沉淀的质量是 ▲ g。(6分)
(2)在2L恒容的密闭容器中,加入1molN2和3molH2,在一定温度和催化剂条件下使其反应,当反应到8min时达到平衡,此时NH3的浓度c (NH3) = a mol•Lˉ1;分离出NH3,剩余气体回收于原容器,再向该容器通入1molN2和3molH2,平衡时N2的转化率比第一次增大5%,c (NH3) = b mol•Lˉ1。
①下列属于工业上增加氮气转化率的措施是 ▲ ;
A、提高反应温度至500℃ B、使用催化剂
C、增大压强至20-50MPa D、充入过量的氮气
②第一次达到平衡时c(N2)=c(NH3),则a= ▲ ;第二次达到平衡时b= ▲ ;
26.(12分)下列图中A-J分别代表相关反应中的一种物质,已知A是常用作肥料的无机盐,A分解得到相等物质的量的B、C、D,已知F是一种单质,图中有一些生成物未写出。
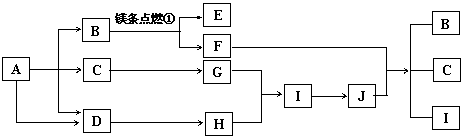
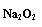
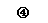

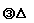
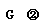
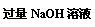
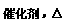
请填写以下空白:
(1)A的化学式___▲___,D的电子式__▲__ ,B物质的晶体类型为__▲ 。
(2)写出反应②的化学方程式:_______▲_____;
(3)写出反应④的化学方程式,并标出电子的转移方向和数目:____▲______。
27(16分)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。

已知: ①三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。
②V2O5在450℃左右,活性最好,温度过高或过低都会使催化剂活性下降。
试回答:
(1)已知3.2g二氧化硫被氧气完全氧化成气态三氧化硫时,可以放出4.915kJ热量。反应的热化学方程式为 ▲ ;
(2)A装置可用来观察二氧化硫和氧气的进气量。实验时使A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是 ▲ ;A中的药品是 ▲ ;
(3)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是
▲ ;
(4)在实验过程中不能持续加热的理由是 ▲ ;
(5)C装置用来收集三氧化硫,其中冰盐水的作用是 ▲ ;
(6)为了减轻实验对环境的污染,请你设计尾气处理装置,用简要文字回答: ▲ 。
 28.(17分)已知如下信息:
28.(17分)已知如下信息:
① RNH2+R∕CH2Cl RNHCH2R∕+HCl (R和R∕代表烃基)
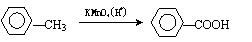
② 苯的同系物能被高锰酸钾氧化,如:

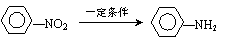 ③
③

化合物C是制取消炎灵(盐酸祛炎痛)的中间产物,其合成路线为:
请回答下列问题:
(1)写出反应④的主要产物中含有的官能团的结构简式(除苯环外)____▲____;
(2)写出B、C物质的结构简式是_____▲_____, ▲ ;
(3)写出反应①②的化学方程式 ①______▲____,②___▲____;
(4)反应①-⑤中,属于取代反应的有(填反应序号)______▲____;
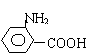 (5)写出符合下列要求的
的含有苯环的同分异构体
(5)写出符合下列要求的
的含有苯环的同分异构体
①含硝基的(任选一种) ▲ ;②属于酯类(任选一种) ▲ 。
13.下列说法中正确的是
A.常温下醋酸分子不可能存在于pH > 7的溶液中
B.常温下等物质的量浓度的醋酸钠、碳酸钠、碳酸氢钠溶液pH依次增大
C.0.2 mol •Lˉ1的醋酸钠溶液中各离子浓度大小可能的关系是:
c(Na+) > c(CH3COOˉ)> c( OHˉ)> c( H+)
D.c( H+)=1×10ˉ13 mol•Lˉ1的溶液中,一定能大量存在Al3+、Clˉ、NH4+、NO3ˉ
12.某氢氧燃料电池所消耗的原料为H2和O2,电极为多孔镍,电解质溶液为30%的KOH溶液,下列有关说法中正确的是
A.正极反应为 4 OHˉ- 4eˉ= 2 H2O + O2
B.负极反应为 2 H2 + 4 OHˉ-4 eˉ= 4 H2O
C.工作时,正极区pH下降
D.工作时,溶液中阴离子移向正极
11.以下因果关系中不成立的是
A.苯酚具有弱酸性,其原因是羟基对苯环的影响
B.蛋白质溶液可发生丁达尔效应,其原因是分散质微粒直径在10-9m~10-7m之间
C.冰的密度小于液态水、水的沸点高于硫化氢等性质,其原因是与氢键的存在有关
D.配制一定物质的量浓度的溶液时,要洗涤烧杯,其原因是防止溶质流失
10.下列实验方案合理的是
A.用氢氧化钠溶液除去乙酸乙酯中混有的乙酸等杂质
B.制备FeCl3溶液时,先将固体溶于较浓盐酸,再加水稀释
C.用加入浓溴水的方法分离苯和苯酚的混合物
D.用润湿的pH试纸测量某酸溶液的pH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com