
题目列表(包括答案和解析)
24、( )强酸和强碱的稀溶液的中和热可表示为H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);ΔH=-Q1kJ/mol
1/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);ΔH=-Q2kJ/mol
HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=-Q3kJ/mol
则Q1、Q2、Q3关系正确的是
A Q1=Q2=Q3 B Q1>Q2>Q3 C Q2>Q3>Q1 D Q1<Q2=Q3
23、( )由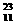 Na、
Na、 Cl、
Cl、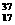 Cl(氯元素的平均原子量为35.5)构成11.7克氯化钠中含
Cl(氯元素的平均原子量为35.5)构成11.7克氯化钠中含 的质
的质
量为
A 1.85克 B 8.70克 C 1.775克 D 5.325克
22、( )下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A C(s)+1/2O2(g)=CO(g);△H=-110.5kJ/mol
B CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol
C 2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D CO(g)+1/2O2(g)=CO2(g);△H=-283kJ/mol
21、( )已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙
炔燃烧的热化学方程式正确的是
A 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g);ΔH=-4bkJ/mol
B C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=-2bkJ/mol
C 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=4bkJ/mol
D 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=2bkJ/mol
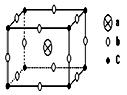
20、( )某离子晶体的晶胞结构如下图所示:
则该离子晶体的化学式为
A abc B abc3 C ab2c3 D ab3c
19、( )下列反应既属于氧化还原反应,又属于吸热反应的是
A 铝片与稀盐酸反应 B Ba(OH)2·8H2O与NH4Cl的反应
 C 灼热的碳与CO2的反应 D 甲烷在氧气中的燃烧反应
C 灼热的碳与CO2的反应 D 甲烷在氧气中的燃烧反应
18、( )在常温下,发生下列几种反应:①16H++10Z-+2XO4-→2X2++5Z2+8H2O;②2A2+
+B2→2A3++2B-;③2B-+Z2→B2+2Z-。根据上述反应,判断下列结论中错误的是
A 溶液中可发生:Z2+2A2+→2A3++2Z-
B Z2在①、③反应中为还原剂
C 氧化性强弱的顺序为:XO4->Z2>B2>A3+
D X2+是XO4-的还原产物
17、( )右表为元素周期表短周期的一部分,有关元素X、Y、Z、M的说
法不正确的是
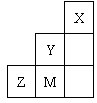 A X晶体的结构微粒是原子,故属于原子晶体
A X晶体的结构微粒是原子,故属于原子晶体
B Y的氢化物沸点比M的氢化物的沸点高
C 原子半径:Z>M>Y
D Z离子的结构示意图可表示为: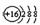
16、( )下列说法中正确的是
A 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C 最外层有2个电子的原子都是金属原子
D 最外层有5个电子的原子都是非金属原子
15、( )A、B、C、D、E是同一周期的五种主族元素,A与B的最高氧化物对应的水化物呈碱
性,且碱性B>A;C和D的气态氢化物稳定性为C>D;E是这五种元素中原子半径最
小的元素,则它们的原子序数由小到大的的顺序为
A ABCDE B CDABE C BADCE D ECDBA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com