
题目列表(包括答案和解析)
34、(10分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可
以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断
裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC______Si;SiCl4_________SiO2
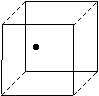
(2)右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体
的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)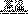 Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热△H=_____________kJ/mol
33、(8分)有X、Y、Z、W四种短周期元素,原子序数依次增大,其质子总数为38。Y元素原
子最外层电子数占核外总电子数的3/4;W元素原子最外层电子数比同周期Z元素原子最外
层多5个电子;W和Y不属于同一主族。
(1)用电子式表示表中Z、W两元素形成化合物的过程
(2)X、Y两元素形成的18电子化合物的电子式为
(3)把Z的单质放入滴有酚酞的沸水中,观察到的现象是 。
(4)Z、W两元素最高价氧化物对应水化物反应的化学方程式是
。
32、(12分)右表是元素周期表的一部分.
族
 周期 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
|
|
④ |
⑤ |
|
|
3 |
⑥ |
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素⑩的氢化物的电子式为 ,此氢化物的还原性比元素⑨的氢化物的
还原性 (填强或弱)
(2)⑥的单质在⑤的单质中燃烧产物的电子式为
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似
的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
;
(4)两种短期元素组成的常见化合物中,原子个数比为1︰3,若两种元素原子序数分别为
a和b,则a和b的关系可能是(填序号)_________________________
①a=b+5 ②a+b=30 ③a+b=8 ④a=b+8 ⑤a=b+1
(5)用电子式表示表中①⑨两元素形成化合物的过程
。
31、(10分)在构成下列物质微粒中,①氨气,②氯化氢,③氯化铵,④二氧化碳,⑤苛性钾,
⑥NaCl,⑦氢气,⑧晶体硅,⑨白磷,⑩Na2O2。
(1)只有非极性键的是(填序号,下同) ;
(2)只含有极性键的是 ;
(3)只含有离子键的是 ;
(4)既含有离子键,又含有极性键的是 ;
(5)含有离子键又含有非极性键的是 。
30、( )下面关于晶体的叙述中,错误的是(NA表示阿佛加德罗常数)
A 在石墨晶体的片层结构中,最小的环上有6个碳原子,12g石墨含有0.5NA个六边形
B 氯化钠晶体中,每个Na+周围距离相等的Na+共有6个
C 在60g SiO2晶体中,含有4NA个Si-O键
D 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
第Ⅱ卷(非选择题,共40分)
29、( )目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60
分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述错误的是
A 该晶体属分子晶体 B 该分子内原子间都以极性共价键相连接
C 该物质是一种新化合物 D 该物质的相对分子质量为2400
28、( )2003年10月15日我国成功发射了第一艘载人航天飞船--“神州五号”。从此我国进
入了航天大国和航天强国行列。发射“神五”时用肼(N2H4)作为火箭发动机的燃料,
NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol。
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol。
下列关于肼和NO2反应的热化学方程式中,正确的是
A 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7kJ/mol
B 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3kJ/mol
C N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-466.3kJ/mol
D 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ/mol
27、( )下列说法或表示法正确的是
A 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B 由C(s,石墨)→C(s,金刚石);ΔH=+119kJ/mol可知,金刚石比石墨稳定
C 在稀溶液中:H++OH-=H2O;ΔH=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸
与含1 mol NaOH的溶液混合,放出的热量大于57.3kJ
D 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,表示氢气燃烧热的热
化学方程式表示为2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol
26、( )下列说法正确的是
A 水加热到很高的温度都难以分解是因为水分间能形成氢键
B 水结成冰体积膨胀,密度变小与水分间形成氢键有关
C CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高是因为分子内共价键键能
逐渐增大
D HF、HCl、HBr、HI的热稳定性依次减弱是因为分子间作用力依次减弱
25、( )已知
(1)H2+1/2O2=H2O(g) △H1=a kJ·mol-1
(2)2H2+O2=2H2O(g) △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)=H2O(l) △H3=c kJ·mol-1
(4)2H2(g)+O2(g)=2H2O(l) △H4=d kJ·mol-1
下列关系式中正确的是
A a<c<0 B b>d>0 C 2a=b<0 D 2c=d>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com