
题目列表(包括答案和解析)
8.下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应ks*5u
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
7.已知还原性Cl-<Fe2+<H2O2<I-<SO2,判断下列反应不能发生的是
A)2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ B)I2+SO2+2H2O=H2SO4+2HI
C)H2O2+2H++SO42-=SO2+O2+2H2O D)2Fe3++2I-=2Fe2++I2
6. 下表所列各组物质中,物质之间通过一步反应就能实现如右图所示转化的是
下表所列各组物质中,物质之间通过一步反应就能实现如右图所示转化的是
|
|
a |
b |
c |
|
A) |
Al |
AlCl3 |
Al(OH)3 |
|
B) |
HNO3 |
NO |
NO2 |
|
C) |
Si |
SiO2 |
H2SiO3 |
|
D) |
CH2=CH2 |
CH3CH2OH |
CH3CHO |
5.下列离子方程式正确的是
A)向盐酸中滴加氨水:H+ + OH- = H2O
B)Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.Cu2+溶液中滴加过量的氨水: Cu2+ +2NH3·H2O = Cu(OH)2↓+ 2NH4+
D.稀释氯化钴溶液,溶液颜色由蓝色逐渐变为粉红色:
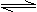 [CoCl4]2- + 6H2O
[Co(H2O)6]2++ 4Cl-
[CoCl4]2- + 6H2O
[Co(H2O)6]2++ 4Cl-
3.下列有关物质结构的表述正确的是
 A.次氯酸的电子式
A.次氯酸的电子式 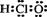 B.二氧化硅的分子式 SiO2
B.二氧化硅的分子式 SiO2
C. 碳-12原子 126C D.钠离子的结构示意图
4下列说法错误的是
A. 食醋用氢氧化钠溶液滴定开始时,溶液的PH通常变化缓慢,当接近完全反应时(即
滴定终点),PH出现突变,称为滴定突跃。
B. 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。
C. 甲烷的标准燃烧热为△H=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D 应用盖斯定律,可计算某些难以直接测定的反应焓变
2. 若将NaOH(s)、P2O5(s)、无水CaCl2(s)归为一类。从A-D中选出一种最适宜与这三种物质归为一类的是
A)浓硫酸 B)氯化钠 C)碱石灰 D)生石灰
1.化学已渗透到人类生活的各个方面。下列说法正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.Al2O3 、MgO可用作高温材料,二氧化硅是生产光纤制品的基本原料
C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.用纯碱制玻璃 、用铁矿石炼铁、用氨制碳酸铵都会产生产生温室气体
25.已知某混合金属粉末,除铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:(1)提出假设:
假设1:该混合金属粉末中除铝外还含有 元素;
假设2:该混合金属粉末中除铝外还含有 元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案 基于假设3,设计出实验方案。 (3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
|
|
|
24.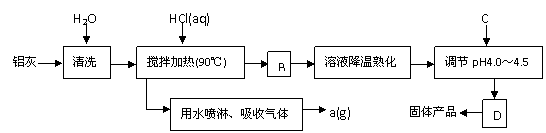 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
|
。
(2)生产过程中B和D的操作名称分别是 和 (B和D均为简单操作)。
(3)反应中副产品a是 。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
23.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式是 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格。B 、D 、E 。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵: 。
(5)若从装置C的G处逸出的尾气中含有N2和少量C12,应如何处理?
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com