
题目列表(包括答案和解析)
23.(1)OH-、Na+ Cl-、NO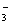 (2)OH-、HCO
(2)OH-、HCO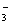 、NO
、NO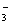 、Ag+
、Ag+
24答案:(1)1、5、8、1、5、4 (2)0.007 (3)19.6 (4)40%
22.(1)Fe2O3 + 2Al Al2O3 + 2Fe
(2)2Al + 2H2O + 2OH-=2AlO2-+ 3H2↑
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+。
②Al3+ + 3H2O
Al2O3 + 2Fe
(2)2Al + 2H2O + 2OH-=2AlO2-+ 3H2↑
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+。
②Al3+ + 3H2O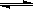 Al(OH)3
+ 3H+
③2FeSO4 + 2NaNO2
+ H2SO4=2Fe(OH)SO4 + Na2SO4 + 2NO↑
Al(OH)3
+ 3H+
③2FeSO4 + 2NaNO2
+ H2SO4=2Fe(OH)SO4 + Na2SO4 + 2NO↑
21.(1)饱和食盐水 稀盐酸或水
(2)碱溶液的浓度不同,反应温度不同
②3Cl2+6OH―
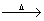 ClO3―+5Cl―+3H2O
M 过滤
ClO3―+5Cl―+3H2O
M 过滤
(3)
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为
红 色 |
氯气与水反应生成的H+使石蕊变化 |
|
随后溶液逐渐变为无色 |
氯气与水反应生成HClO将石蕊氧化成无色物质 |
(4)用氢氧化钠溶液吸收尾气,防止污染空气
25.(12分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入2mol·L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。试回答下列问题:
(1)图中OC段发生反应的离子方程式为:_ 。
(2)在DE段发生反应的离子方程式为:
_________ __。
(3)在EF段发生反应的化学方程式为:
_________ __。
(4)B与A的差值为 mol。
(5)B点对应沉淀量为:__________mol,C点对应的氢氧化钠溶液的体积为:_________mL。
非选择题答案
23.(6分)在某无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、Cl-、OH-、HCO3-、NO3-。已知该溶液能跟铝粉反应,且放出的气体只有H2。试回答:
(1)若溶液和铝粉反应后有AlO2-生成,则溶液中一定含有大量的__________________离子,还可能含有大量的_______________________离子。
(2)若溶液和铝粉反应后有Al3+生成,则原溶液中一定不含有大量__________________离子。
24(9分)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL0.1mol/LFe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O的质量为
g。
(4)混合物中Cu2S的质量分数为 。
22.(11分)下列转化关系图中,A、B、C、D在常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。
请回答下列问题:
(1)C的电子式为 。
(2)检验溶液L中金属阳离子的方法是 。
(3)反应③的离子方程式为 。
(4)F与G的浓溶液反应的化学方程式为 。
(5)气体A的密度为2.68g·L-1,(标准状况),通过计算、推理,可确定A的分子式为
。
21.(12分)在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水性质。
 图中:①为氯气发生装置;②的试管里盛有15mL
30%KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
图中:①为氯气发生装置;②的试管里盛有15mL
30%KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
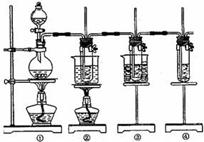
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
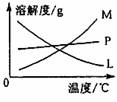 。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是
(填写编号字母);从②的试管中分离出该晶体的方法是
(填写实验操作名称)
。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是
(填写编号字母);从②的试管中分离出该晶体的方法是
(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式为 。
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为
色 |
|
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
20.研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2。他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
A . 0.448L B. 2.240L C.2.016L D.无法确定
信阳高中2010-2011学年度高三年级第一次大考
化 学 试 题
第II卷(非选择题,共50分)
19.向含1 mol HCl和1 mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )
18.25℃时,在25mL 0.1mol/L 的NaOH溶液中逐滴加入0.2mol/L 的醋酸溶液,溶液的pH变化如图所示,下列分析的结论正确的是( )
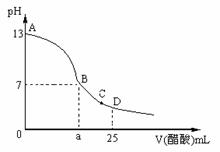
A.B点的横坐标a=12.5
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-) +c(CH3COOH)=2c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:c(Na+)>c(CH3COO-)> c(OH-) > c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com