
题目列表(包括答案和解析)
19、(12分)描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
|
酸或碱 |
电离常数(Ka或Kb) |
|
CH3COOH |
1.8×10-5 |
|
HNO2 |
4.6×10-4 |
|
HCN |
5×10-10 |
|
HClO |
3×10-8 |
|
NH3·H2O |
1.8×10-5 |
表1
|
难(微)溶物 |
溶度积常数(Ksp) |
|
BaSO4 |
1×10-10 |
|
BaCO3 |
2.6×10-9 |
|
CaSO4 |
7×10-5 |
|
CaCO3 |
5×10-9 |
表2
请回答下面问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是 (填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”),理由是
。
(3)物质的量l:l的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应 ≥ mol·L-1
18. (14分)“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
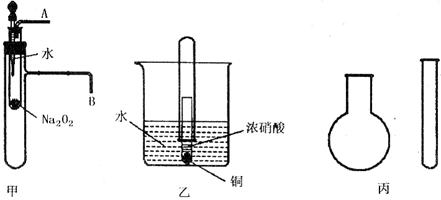
[实验一] 图甲是对课本有关Na2O2某性质的两个实验的改进。
(1)将胶头滴管中的水滴入小试管,然后,在导管口A、B处分别进行适当操作,再根
据所观察现象可得到的两个结论是____________________,__________________。
(2)写出甲中反应的离子方程式_________________________________________。
[实验二] 图乙是对铜和浓硝酸反应实验的改进。
(3)写出铜和浓硝酸反应的离子方程式为_________________________________。
(4)反应开始后,能观察到的现象是__________________________________,随后气体颜色逐渐变浅;大试管中液面上升。
(5)与普通演示实验相比,此实验设计除操作方便之外,还有_____________等优点。
[实验三] 现有下列药品:A、氯化铵固体 B、氢氧化钠固体 C、浓氨水
D、浓硫酸 E、碳酸氢铵。采用“套管法”,只用一支试管(药匙等辅助用品略,不加热),选择合适的药品就可在圆底烧瓶中集满喷泉实验用的氨气(如图丙)。
(6)此实验制备氨气选用的最合适药品是__________(填序号)
17.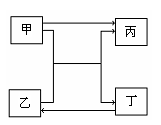 (16分)右图中的甲、乙、丙和丁分别代表一种反应物或生成物,相互转化关系中部分反应条件略。请根据题目要求回答下列问题。
(16分)右图中的甲、乙、丙和丁分别代表一种反应物或生成物,相互转化关系中部分反应条件略。请根据题目要求回答下列问题。
(1)若甲和乙均为含有10个电子的带电粒子,丙和丁
均为含有10个电子的分子,写出甲和乙共热时的
离子方程式 ;
若将丙溶入丁物质中,应选择的吸收装置为
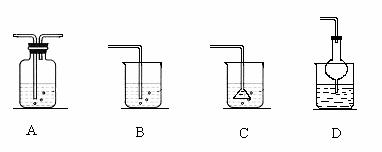 (填序号)。
(填序号)。
(2)若甲和乙均为含有18个电子的共价化合物,丁为黄色固体,则甲的电子式为
(3)若甲是含有10个电子的化合物,乙是含有18个电子的单质分子,写出甲和乙反应的
化学方程式 ;当乙发生反应
时,转移0.1mol电子,则标况下有 L单质气体乙参加反应。
(4)若甲、乙中均含有常见金属元素,甲为单质,乙中两元素原子的质量比为21:8,则
甲、乙发生反应的化学方程式为 。
(5)若甲和丁为非金属单质,乙和丙为非金属氧化物,则甲和丁可能为 、
(列出常见的两组的名称)。
16. 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )
 A.该电池能够在高温下工作
A.该电池能够在高温下工作
B.图中a为电池的负极,b为正极
C.放电过程中,H+从正极区向负极区迁移
D.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
第Ⅱ卷(非选择题 共52分)
15. 化学在生产和日常生活中有着重要的应用。下列说法不正确的是 ( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶人锌块,可减缓船体的腐蚀速率
C.工业制铝的原料是A1C13,可以降低能耗
D.MgO的熔点很高,可用于制作耐高温材料
14. 下列实验过程中,始终无明显现象变化的是 ( )
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
13. 下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子(H+)能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
12. 将标准状况下,将VL A气体(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为ρg·cm-3,则此溶液的物质的量浓度(mol·L-1)为: ( )
A. B.
B.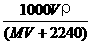 C.
C.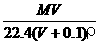 D.1000VρM/(MV+2240)
D.1000VρM/(MV+2240)
11. 常温下,一定量的醋酸与氢氧化钠溶液发生中和反应。下列说法正确的是 ( )
A.当溶液中c(CH3COO-) = c(Na+)时,醋酸与氢氧化钠恰好完全反应
B.当溶液中c(CH3COO-) = c(Na+)时.一定是氢氧化钠过量
C.当溶液中c(CH3COO-) = c(Na+)>c(H+) = c(OH-)时,一定是醋酸过量
D.当溶液中c(Na+)>c(CH3COO-) >c(OH-)>c(H+)时,一定是氢氧化钠过量
10. 下列实验中金属或氧化物可以完全溶解的是 ( )
A.1 mol铜片与含2 molH2SO4的浓硫酸共热
B.1 mol MnO2粉末与含2 mol H2O2的溶液共热
C.常温下1 mol铝片投入足量的浓硫酸中
D.常温下1 mol铜片投人含4 mol HNO3的浓硝酸中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com