
题目列表(包括答案和解析)
27.(14分)1 L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
|
可能大量含有的阴离子 |
Cl- Br- I‑ ClO‑ AlO2- |
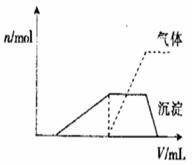 ⑴往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(
⑴往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(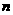 )与加入NaOH溶液的体积(
)与加入NaOH溶液的体积(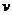 )的关系如右图所示。
)的关系如右图所示。
则该溶液中确定含有的离子有_______________;
不能确定是否含有的阳离子有______________,
要确定其存在可补充做的实验是____________;
肯定不存在的阴离子有___________________。
⑵经检测,该溶液中含有大量的Cl- 、Br-、I-,若向1 L该
混合溶液中通入-定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入
Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
2.8L |
5.6 L |
11.2 L |
 (X-) (X-) |
1.25mol |
1.5 mol |
2 mol |
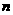 (Y-) (Y-) |
1.5 mol |
1.4 mol |
0.9 mol |
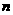 (Z-) (Z-) |
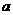 mol mol |
0 |
0 |
①a=___________________;
②当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为________________。
③原溶液中Cl-、Br-、I-的物质的量浓度之比为c(Cl-):c(Br-):c(I-)=______________________。
26.(10分)硝酸铜受热易分解:2Cu(NO3)2  2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO  2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2⇌N2O4,2NO2=2NO+O2等反应)。
2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2⇌N2O4,2NO2=2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
⑴若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是__________g。
⑵若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是________(填分子式),其体积(标准状况)是_____________L。
⑶若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是_________g。
25.下述实验操作和结论表达正确的是 ( )
|
编号 |
实验操作 |
实验结论 |
|
A |
标况下,用等体积烧瓶各收集满NH3和HCl气体作喷泉实验,假设两烧瓶内充满溶液且溶质的不扩散 |
实验后,两溶液的物质的量浓度和质量分数都不同 |
|
B |
量筒量液体体积时,平视读数为V1mL,仰视读数为V2mL,俯视读数为V3mL |
则V3>V1>V2 |
|
C |
用托盘天平称量5.5 g食盐,操作时食盐与砝码的位置放颠倒了 |
实际称得食盐的质量为6.0 g |
|
D |
将SO2气体通入KMnO4溶液中,溶液褪色 |
证明SO2具有漂白性 |
非选择题(共40分)
24.水热法制备Fe3O4纳米颗粒的反应为3Fe2+ + 2S2O32-+ O2 +
xOH- Fe3O4+S4O62-+2H2O,下列说法中,不正确的是
(
)
A.每生成1mol Fe3O4,反应转移的电子总数为4mol B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol D.x=4
23.有3份等质量的小苏打,第1份直接与过量盐酸反应;第2份先加热,使其部分分解后,再与过量盐酸反应;第3份先加热,使其完全分解后,再与过量盐酸反应。假若盐酸的物质的量浓度相同,实际消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是 ( )
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V1=V2=V3
22.将11.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是 ( )
A.0.3mol NO2 和0.3mol NO B.0.1mol NO、0.2mol NO2和0.05mol N2O4
C.0.2mol NO2和0.1mol N2O4 D.0.6mol NO
21.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):下列判断正确的是 ( )
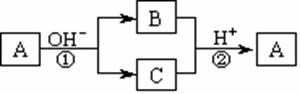 A.X元素可能为Al
A.X元素可能为Al
B.X元素一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②不一定为氧化还原反应
20.在分开盛放的M、N两溶液中,各含下列十四种离子中的七种:Al3+、Na+、K+、Fe3+、NH4+、H+、Cl-、NO3-、OH-、S2-、MnO4-、SO42-、AlO2-、CO32-,且两溶液里所含离子不相同,已知M溶液中的阳离子只有两种,则N溶液中的阴离子应该是 ( )
A.NH4+ S2- CO32- B.MnO4- SO42- NO3-
C.NO3- Cl- SO42- D.AlO2- SO42- MnO4-
19.著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是 ( )
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4 + 2H2↑
CeI4 + 2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ == Ce3+ + 2Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.四种的核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同素异形体
18.有下列四种判断:①两种弱酸相互反应生成两种强酸;②两种弱酸盐相互作用后生成两种强酸盐;③一种弱酸和一种盐溶液作用后,得到一种强酸和一种盐;④两种酸溶液混合后,溶液的酸性减弱。其中有具体例证的是 ( )
A.①②③④ B.②③ C.②③④ D.①②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com