
题目列表(包括答案和解析)
8.下列是某同学对相应反应的离子方程式所作的评价,其中合理的是

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
|
编号 |
化学反应 |
离子方程式 |
评价 |
||
|
A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH = CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
||
|
B |
甲醛和足量银氨溶液充分反应 |
HCOO |
正确 |
||
|
C |
NaHSO3溶液的水解 |
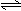 HSO3-+H2O SO32-+H3O+ HSO3-+H2O SO32-+H3O+ |
错误,水解方程式写成了电离方程式 |
||
|
D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
错误,Fe2+与Br-的物质的量之比与化学式不符 |
7.阿伏加德罗常数为NA,下列说法中不正确的是

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
A.足量Zn与一定量的浓硫酸反应,产生22.4 L(标况)气体时,转移的电子数一定为2NA
B.2 mol SO2和1 mol O2 混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA
C.71g氯气通入足量水中,反应中转移的电子总数为NA
D.6 g SiO2晶体中含有的硅氧键数为0.4NA
6.下列有关化学用语使用正确的是
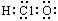 A.质量数为37的氯原子:
A.质量数为37的氯原子: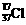 B.次氯酸分子的电子式:
B.次氯酸分子的电子式:
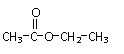
C.乙酸乙酯的结构式:
D.Al(OH)3的电离:H+ +
AlO2- + H2O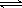 Al(OH)3
Al(OH)3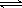 Al3+
+3OH-
Al3+
+3OH-
5.下述实验不能达到预期目的的是

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
|
|
实验内容 |
实验目的 |
|
A |
将AlCl3溶液蒸干灼烧 |
制备Al2O3 |
|
B |
向淀粉水解后的溶液中,依次加入NaOH溶液、新制Cu(OH)2,共热 |
探究水解产物的还原性 |
|
C |
向某溶液中加入稀硫酸,将产生的气体通入澄清石灰水 |
检验该溶液中是否含有CO32- |
|
D |
向H2O2溶液中滴加少量FeCl3溶液 |
探究催化剂对化学反应速率的影响 |
4.下列判断不正确的是
A.微粒半径:S2->K+>F B.沸点:HCl < HF
C.反应速率:Fe加入稀H2SO4中 < Fe加入稀H2SO4和含少量CuSO4的混合溶液中
D.给出质子的能力:CH3COOH>C2H5OH>H2O
3.已知某溶液中存在较多的SO42-、NO3-,则溶液中还可能大量存在的离子组是
A.Fe3+、AlO2-、Cl- B.Na+、NH4+、S2-
C.H+、Cl-、Fe2+ D.Mg2+、Ba2+、Br-
2.下列各组化学式表示分子的是
A.NaCl、H2O、CO2、H2S B.Ne、NH3、P2O5、H2SO4
C.Na2SO4、NH4NO3、PH3、H2S D.Si、S、SO2、CO
1.下列说法正确的是
A.MgO、Al2O3的熔点很高,可作耐高温材料,工业上用热还原法冶炼对应的金属
B.氢氧化钠、碳酸氢钠、氢氧化铝都可用作抗酸药
C.甲醛的水溶液具有杀菌、防腐的作用,可用于海产品保鲜
D.糖类、油脂、蛋白质、维生素、无机盐和水是人体所需的六大营养素
29.(6分)海水中含有多种盐类物质,在一定温度下将海水浓缩,其间会不断有晶体析出,且海水的密度逐渐增大,下表为一定温度下不同密度(g/mL)的海水中几种盐类的含量(g/L)。回答下列问题:
|
海水密度(g/mL) |
CaSO4 (g/L) |
NaCl (g/L) |
MgCl2 (g/L) |
MgSO4 (g/L) |
NaBr (g/L) |
|
1.13 |
0.56 |
|
|
|
|
|
1.20 |
0.91 |
|
|
|
|
|
1.21 |
0.05 |
3.26 |
0.004 |
0.008 |
|
|
1.22 |
0.015 |
9.65 |
0.01 |
0.04 |
|
|
1.26 |
0.01 |
2.64 |
0.02 |
0.02 |
0.04 |
|
1.31 |
|
1.40 |
0.54 |
0.03 |
0.06 |
(1)在该温度下恒温蒸发海水时,海水的密度从1.13 g/mL增大到1.21 g/mL时是否有硫酸钙析出? ▲
(2)恒温下,当蒸发1 m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为 ▲ kg,析出NaCl的质量为 ▲ kg。
 2010学年温州中学高三10月份月考
2010学年温州中学高三10月份月考
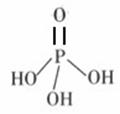
28.(10分)磷单质及其化合物有广泛应用。白磷(P4)是磷的单质之一,易氧化,与Cl2单质反应通常生成PCl3或PCl5。
⑴6.20g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为 L。上述燃烧产物溶于水配成100.0mL磷酸(H3PO4)溶液,需要的玻璃仪器除烧杯,玻璃棒外,还需要____________________________,该磷酸溶液的物质的量浓度为 。
 ⑵含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成l种难溶盐和16.2g H2O。该难溶盐的化学式可表示为
。
⑵含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成l种难溶盐和16.2g H2O。该难溶盐的化学式可表示为
。
⑶同磷灰石[主要成分Ca5(PO4)3F(s)]在高温下制备P4的化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
上述反应中,副产物矿渣可用来 。
⑷三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个水分子产物,
其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
⑸次磷酸钠(NaH2PO2)可用于化学镀镍。
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生下述反应,请配平该离子方程式。
Ni2+ + H2PO2-+ → Ni++ H2PO3-+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com