
题目列表(包括答案和解析)
17.绿原酸是咖啡提取液的成分之一,其结构如图所示。下列关于绿原酸的说法正确的是
A.分子中所有碳原子可能共面
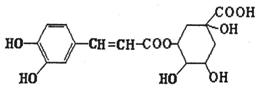 B.一定条件下,1 mol该物质最多与4 molNaOH反应
B.一定条件下,1 mol该物质最多与4 molNaOH反应
C.水解产物都可以与FeCl3溶液发生显色反应
D.1 mol该物质最多与6 mol浓溴水反应
16.短周期元素X、Y、Z和W 的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19, X和Y元素原子的原子序数比6∶7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A.X单质可以通过铝热法获得 B.Y的氧化物是良好的半导体材料
C.Z的氢化物比W的氢化物更稳定
D.X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
15.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。
关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成7.5 g As,还原剂失去的电子为0.3 mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
14.化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子法”表示的化学方程式
正确的是

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
A.2Na2O2+2H218O=4NaOH+18O2↑
B.CH3COOH+CH3CH218OH→CH3COOCH2CH3+H218O
C.5H218O2+2KMnO4+3H2SO4=518O2↑+K2SO4+2MnSO4+8H2O
D.K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
13.甲、乙、丙、丁都是第三周期元素形成的单质,下列叙述正确的是
A.1mol单质甲完全燃烧生成的氧化物与热烧碱溶液反应,最多消耗12 mol NaOH,甲的分子结构为正四面体。
B.1mol单质乙完全燃烧生成的氧化物与烧碱溶液反应,最多消耗1 mol NaOH,乙的氧化物的熔点较低。
C.1mol单质丙完全燃烧生成的氧化物与烧碱溶液反应,最多消耗16 mol NaOH,晶体丙是原子晶体。
D.1mol单质丁完全燃烧生成的氧化物与烧碱溶液反应,最多消耗2 mol NaOH,丁是良好的半导体。
12.关于下列图示的说法中正确的是
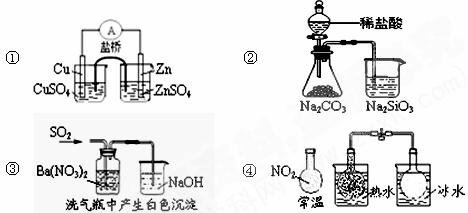
A.图①能组成Zn、Cu原电池 B.图②能证明非金属性Cl>C>Si
C.图③白色沉淀为BaSO3
D.图④说明反应2NO2 N2O4(无色)△H>0
N2O4(无色)△H>0
11. 以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+
SO2(l) SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+
SO2(l) SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
A.自离解的存在,说明SO2是离子化合物
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数 C.该滴定反应可以表示为:SO32-+ SO2+ = 2SO2 D.可通过导电能力变化来判断是否到达滴定终点
1.0×10-a mol·L-1和是1.0×10-b mol·L-1,在此温度时,水的离子积为1.0×10-(b+a)
10.下列叙述正确的是
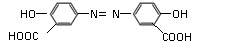
A.1 mol奥沙拉嗪 ( ) 与足量Na2CO3溶液反应能生成4 mol CO2
B.已知反应mX(g)+nY(g) qZ(g) ,若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为1∶1
qZ(g) ,若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为1∶1
C.1 L 1 mol/L Na2CO3溶液中含有3×6.02×1023个离子
D.在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是
9.下列各组溶液中,只用括号内的试剂及物质间相互反应无法鉴别的一组是
A.Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液)
B.NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液)
C.NaBr、HCl、KI、CaCl2(AgNO3溶液)
D.NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液)

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com