
题目列表(包括答案和解析)
7.下列反应的离子方程式书写正确的是 ( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D.在溴化亚铁溶液中通入过量的氯气:Cl2+2Fe2++2Br-=2Fe2++2Cl-+Br2
6.下列溶液中有关微粒的物质的量浓度关系正确的是 ( )
A.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
B.相同条件下,pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸溶液中由水电离的c(H+):①>②>③
C.PH相等的①NH4Cl;②(NH4)2SO4;③NH4HSO4三种溶液中,c(NH4+)大小顺序
①=②>③
D.0.1mol/L醋酸钡溶液中,c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
5. 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
A.加少量醋酸钠固体 B.降低温度
C.加少量冰醋酸 D.加水
4.下列各组离子在指定溶液中可能大量共存的是 ( )
A.无色溶液中:Na+、K+、MnO4-、SO42-
B.在能使酚酞试液显红色的溶液中:K+、Na+、S2-、SO32-、
C.使甲基本橙变红的溶液中:Al3+、NO3-、I-、Cl-
D.加入铝能放出氢气的溶液中:Na+、K+、Cl-、HCO3-
3.A、B、C、D四种短周期元素的原子半径依减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是 ( )
A.X、Y、Z三种化合物的稳定性逐渐减弱
B.X、Y、Z三种化合物的熔沸点逐渐降低
C.A、B元素的最高价氧化物的水化物的酸性逐渐减弱
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
1.NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.标准状况下,11.2L四氯化碳所含分子数为0.5NA
B.0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
C.7.8g Na2O2中阴、阳离子总数为0.4NA
D.4.5g SiO2晶体中含有的硅氧键数目为0.3NA
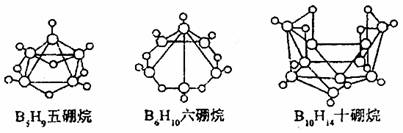 2.2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest)。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是 ( )
2.2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest)。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是 ( )
|
B.2B5H9+12O2 5B2O3+9H2O,1mol B5H9完全燃烧转移25mol电子
C.8个硼原子的剿式硼烷化学式应为B8H10
D.硼烷与水反应是非氧化还原反应
(一)实验室制备
制备非金属单质,要结合非金属元素及其化合物的性质、存在来考虑。
[组织讨论]实验室通常用哪些方法来制备非金属单质?请同学们通过讨论,给以归纳总结。
分小组读书讨论、归纳总结如下:
1.还原法
用还原剂还原的方法来制备,如H2:
Zn+2H+→Zn2++H2↑</PGN0110.TXT/PGN>
2.氧化法
用氧化剂氧化非金属阴离子的方法来制备(包括用同一种非金属元素的高价态氧化该元素的低价态来制备单质。),如:Cl2、Br2、I2、(N2)等。
MnO2+4HCl→MnCl2+Cl2↑+2H2O
(或用KMnO4、KClO3等做氧化剂;Br2可类似制备)
Cl2+2X-(Br-、I-)→X2+2Cl-
3.加热分解法
在加热条件下使某些化合物发生分解反应以制备单质,如:O2
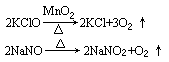
也可通过其他分解反应来制备O2:
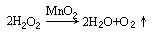
2Na2O2+2H2O→4NaOH+O2↑
4.分离法
将空气通过NaOH溶液、浓硫酸、灼热的铜网后,可得较纯净的N2气体。
[投影]例5 根据下图实验,填空和回答问题
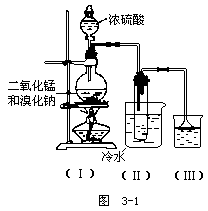
(1)烧瓶中所发生的主要反应的化学方程式为:______
装置(Ⅱ)的烧杯中冷水的作用是:______
装置(Ⅲ)的烧杯中液体的作用是:______
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为______。
(3)装置(Ⅲ)的烧杯中使用倒置漏斗可防止液体倒吸,试简述其理由______。
[组织讨论]请分析解题思路并求解。
分析:由题目给定条件知,此为制取单质溴的实验装置,应该选用强氧化剂来氧化Br-成Br2。
在(Ⅰ)中,浓硫酸、二氧化锰和溴化钠发生反应生成溴单质。然后在(Ⅱ)中冷却成液态。故(Ⅲ)是用来吸收尾气中的溴化氢气体的。
由于溴蒸气的强腐蚀性,在实验过程中应避免与橡胶接触。
[提问]非金属单质有怎样的物理性质?请归纳他们的状态、晶体类型及其溶解性。
归纳:
常温下状态:气态H2、N2、O2、F2、Cl2(稀有气体除外);液态Br2;其余为固态。晶体类型:原子晶体B、C、Si;分子晶体:除B、C、Si外的其它(常见)非金属单质。溶解性:除F2与水发生置换反应,Cl2、Br2在水中发生自身氧化还原反应(部分)外,可以说非金属单质均难溶于水。
[投影]例4 有A、B、C、D四种短周期元素,已知A原子最外层电子数比电子层数少,常温、常压下,B2、C2、D2均为无色双原子气体分子。这四种元素的单质和化合物之间在一定条件下存在如下反应:
(1)2A+C2=2AC(3)3B2+D2=2DB3
(2)3A+D2=A3D2(4)2B2+C2=2B2C
请填空:
(1)电子式:AC____,B2C____,DB3____。
(2)DB3分子的空间构型____,是____(填极性或非极性)分子。
(3)A3D2溶于B2C中,发生复分解反应的化学方程式是______。
分析:由A原子最外层电子数比电子层数少→A可能为Li或Mg;
常温、常压下,B2、C2、D2均为无色双原子气体分子→它们可能是H2、N2、O2(五种气体中,F2、Cl2分别为浅黄绿色和黄绿色气体),再结合给定条件判断B-H;C-O;D-N;A-Mg。
所以,相应化合物:
AC-MgO;B2C-H2O;DB3-NH3;
A3D2-Mg3N2。
答案:略。
[提问]1.请分析解题思路;2.怎样把握物质的物理性质?
回答:首先要把握通性,然后根据不同物质类型,突出其代表性和特性。
2.除H、He、B外,最外层电子数≥4;且原子半径比同周期的金属元素小。

2.非金属元素的结构特点?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com