
题目列表(包括答案和解析)
9.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。关于该反应的说法中正确组合是 ( )
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成7.5gAs,还原剂失去的电子为0.3 mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
8.Na在空气中的燃烧产物可用于航天器供氧,其供氧原理可表示为:
2Na2O2+2CO2==O2+2Na2CO3 下列有关说法正确的是 ( )
A.Na2O2中Na的化合价为+2
B.该反应是氧化还原反应中的变价归中反应
C.Na原子半径大于Li原子半径
D.Li在空气中燃烧也能生成Li2O2可用于供氧
7.
 下列化学实验事实及其解释不正确的是 ( )
下列化学实验事实及其解释不正确的是 ( )
 A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
 B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3溶于盐
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3溶于盐
酸
 C.向FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
C.向FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
 D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI Ksp的大。
D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI Ksp的大。
6.下列各组物质,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是 ( )
A.铜. FeCl3溶液 B.稀H2SO4 . NaAlO2溶液
C.稀盐酸. 碳酸钠溶液 D.浓氨水. AgNO3溶液
5.化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2= Na2CO3+ O2, 类推2Na2O2+2SO2= Na2SO3+ O2是错误的,应该是Na2O2+SO2= Na2SO4。下列各组类比中正确的是 ( )
A.由Fe+S  FeS
推测:Fe+Cl2
FeS
推测:Fe+Cl2 FeCl2
FeCl2
B.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,
推测:CO2+NaClO+H2O=NaHCO3+HClO
C.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,
推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
D.由Na2SO3+2HCl=2NaCl+H2O+ SO2↑,
推测:Na2SO3+2HNO3=2NaNO3+H2O+ SO2↑
4.用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.常温常压下,0.2 mol铁在0.2 mol氯气中充分燃烧,转移的电子数为0.4 NA
B.24g镁的原子最外层电子数为1.0NA
C.工业用电解法进行粗铜精炼时,每转移1 mol电子,阳极上溶解的铜原子数必为0.5 NA
D.用溶有1 mol FeCl3的饱和溶液制Fe(OH)3胶体,制成的胶体中含有胶粒数为1.0NA
3.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物; ②沼气和水蒸气都是可再生能源; ③可用丁达尔现象区分溶液与胶体 ④不锈钢和目前流通的硬币都是合金; ⑤盐酸和食醋既是化合物又是酸; ⑥Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到; ⑦小苏打是一种膨松剂,可用于制作馒头和面包. 上述说法正确的是 .. ( )
A.①②③④ B.①②⑤⑥ C.③⑤⑥⑦ D.①③④⑦
2.下列离子方程式书写正确的是 ( )
A.用铂电极电解氯化镁溶液:Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-===BaSO4↓+H2O
C.在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+====2Mn2+ +5O2↑+8H2O
D.溴乙烷与6mol/L氢氧化钠水溶液共热:C2H5Br
+OH-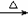 CH2=CH2↑+Br-+H2O
CH2=CH2↑+Br-+H2O
1.某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是 ( )
A.Na+、K+、Cl-、SO42- B.Cu2+、Fe2+、NO3-、SO42-
C.Na+、Ca2+、Cl-、ClO- D.K+、NH4+、Cl-、SO42-
23.(12分)为研究铁质材料与热浓硫酸的反应,某小组进行了以下探究活动:
[探究一]
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分应后得到溶液X并收 集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为____(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KmnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y 中SO2的体积分数为____。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
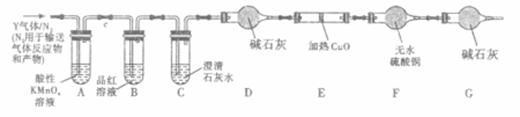
(2)写出产生CO2的化学方程式___ _。
(3)装置A中试剂的作用是____ 。
(4)简述确认气体Y中含有CO2的实验现象 。
(5)如果气体Y中含有H2,预计实验现象应是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com