
题目列表(包括答案和解析)
6. 向一支试管中注入某红色溶液,将试管加热,溶液红色逐渐变浅,则原溶液可能是( )
①滴有石蕊的(NH4)2SO4溶液②滴有酚本的氨水③滴有石蕊的盐酸④滴有酚酞的Na2CO3溶液
A. ①④ B. ②③ C. ①③ D. ②④
30.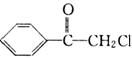 (15分)苯氯乙酮是一种具有荷花香味的有机物,其结构简式如图所示。
(15分)苯氯乙酮是一种具有荷花香味的有机物,其结构简式如图所示。
(1)苯氯乙酮的分子式为 。
(2)苯氯乙酮可能发生的化学反应类型有 (填字母)。
a. 加成反应 b. 取代反应 c. 消去反应 d. 水解反应 e. 酯化反应
(3)苯氯乙酮的一种同分异构体M,不能发生银镜反应,能用于合成杀菌剂F(结构简式为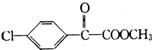 ),由M→F的转化关系如下:
),由M→F的转化关系如下:
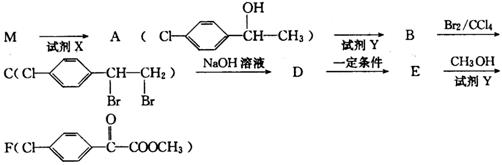
已知:
②通常状况下,氯苯在氢氧化钠在水溶液中不能发生水解反应。
请回答:
①M的结构简式为 ,D中含氧官能团的名称为 。
②反应A→B的化学方程式为 ;反应E→F的化学方程式 。
29.(15分)高铁酸钾(K2FeO4)具有极强的氧化性,因该物质具有“绿色”、选择性高、活性强等特点而受到人们的关注。
(1)高铁酸钾的制务步骤如下:
第一步:在一定温度下,将氯气通入KOH溶液中制得含有次氯酸钾的溶液;
第二步:在剧烈搅拌条件下,将Fe(NO3) 3分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;
第三步:加入KOH至饱和,使K2FeO4充分极出,再经纯化得产品,其纯度在95%以上。
①工业上氯气通常是通过氯碱工业制备,其化学方程式是 。
②温度过高会导致次氯酸钾自身分解生成两种化合物,产物之一是氯酸钾(KClO3),另一咱产物应该是 (写化学式)。
③制备过程中有一步反应如下,请配平方程式(将化学计量数填入横线上)
Fe(OH)
3 + ClO- + 4OH-= FeO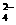 + Cl- + H2O
+ Cl- + H2O
(2)为探究高铁酸钾的稳定性,进行如下实验:
将适量K2FeO4分别溶解于pH为4.74、 7.00、 11.50的水溶液中,配成FeO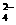 浓度为1.0
浓度为1.0 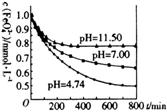 mmol·L-1(1 mmol·L-1=1×10-3mol·L-1)的试样,分别静置800min,考查初始pH不同的水溶液对K2FeO4稳定性的影响,结果如图。
mmol·L-1(1 mmol·L-1=1×10-3mol·L-1)的试样,分别静置800min,考查初始pH不同的水溶液对K2FeO4稳定性的影响,结果如图。
①该实验的结论是
。
②高铁酸钾在水中的反应为4 FeO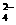 +10H2O
+10H2O 4Fe(OH) 3+8OH-+3O2↑。由上图可知,800min时,初始pH=11.50的溶液中,高铁酸钾的最终浓度比pH=4.74的溶液中高,主要原因是
。
4Fe(OH) 3+8OH-+3O2↑。由上图可知,800min时,初始pH=11.50的溶液中,高铁酸钾的最终浓度比pH=4.74的溶液中高,主要原因是
。
28.(15分)氢气是中学化学中常见的气体之一,它是一种新型的绿色能源,又是一种重要的化工原料。试回答下列有关问题:
(1)氢气燃烧热值很高。实验测得,在常温常压下,1 g H2完全完全燃烧生成液态水时放出142.9 kJ热量,则H2燃烧的热化学方程式为 。
(2)某同学利用铁与硫酸反应制取氢气,实验时发现反应速率较慢,你认为可能的原因是
(填字母)。
a. H2SO4溶液太稀 b. H2SO4溶液太浓 c. 铁的纯度很高 d. 铁的纯度较小
(3)氢气是合成氨的重要原料。工业上合成氨的反应是N2
(g) + 3H2 (g) 2NH3(g)。
2NH3(g)。
①一定条件下,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的变化关系如图所示,其中加入催化剂的时刻是 。
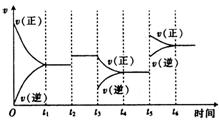
②温度为T0C时,将2a mol H2和a mol N2放入恒容密闭容器中,充分反应达到平衡后测得N2的转化率与平衡混合物中的NH3的体积分数相等,则H2的转化率为 。
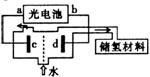 (4)利用光分解水制氢是未来解决能源危机的理想方法之一,某研究机构设计了如图所示的砷化镓光电池系统实现分解水制氢。
(4)利用光分解水制氢是未来解决能源危机的理想方法之一,某研究机构设计了如图所示的砷化镓光电池系统实现分解水制氢。
①光电池的a极为 极;若电解池内电解液是硫酸钠溶液,则d极的电极反应式为 。
②上述装置中能量转化形式为 →电能→ 。
27.(15分)某化学兴趣小组在按图1装置做金属钠在空气中燃烧的实验时,观察到产物不仅仅有淡黄色的固体生成,还有少量的黑色颗粒产生,该小组对黑色颗粒进行了如下探究:
|
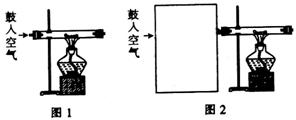
(1)甲同学查阅资料知:4Na + 3CO2 ==== 2Na2CO3 + C,据此推测黑色颗粒可能是 。
(2)乙同学认为只要将图1实验装置稍做改进,即可证明甲同学的猜想是否合理,请在图2的方框中画出装置图并注明相关药品的名称。
(3)丙同学按照乙同学的实验方案进行实验后,仍然发现微量的黑色固体,于是认为可能是金属钠含有其他杂质。他发现在保存钠的试剂瓶的标签上有如下内容:
|
元素符号:Na
纯度:89% 相对原子质量:22.99 杂质含量:氯化物(Cl)-0.003% 氮--0.002% 磷酸盐--0.001% 硫酸盐--0.002% 铁--0.002% |
综合以上信息,丙同学认为微量黑色固体是铁的氧化物,请设计一个简单实验证明丙的结论:
|
实验步骤 |
实验现象及结论 |
|
①收集上述微量黑色固体于试管中,加入过量的稀硫酸 |
固体全部溶解,说明
. |
|
②取少量反应后的溶液于试管中,滴加 |
溶液变血红色,说明固体是铁的氧化物 |
(4)结合以上三位同学的实验探究,你认为图1实验中黑色颗粒的组成为
(填名称)。
13. 由NO、H2、CO2组成的混合气体,通过足量的Na2O2充分反应后,再用电火花引燃使其充分反应,最终只得到质量分数为70%的硝酸,且无其他任何气体剩余。则原混合气体中NO、H2、CO2的体积比为( )
A. 2:4:3 B. 2:4:5 C. 2:4:7 D. 3:5:8
12.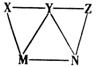 现有KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,存在右图所示的相互反应关系,图中每条连线两端的物质均可以发生化学反应。下列说法中不合理的是( )
现有KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,存在右图所示的相互反应关系,图中每条连线两端的物质均可以发生化学反应。下列说法中不合理的是( )
A. Z可能是氯水 B. Y一定为Na2CO3
C. X一定为KHSO4 D. M、N必定各为BaCl2、FeSO4中的一种
11. 关于下列四个图像的说法中正确的是( )
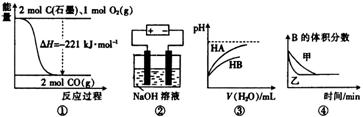
A. 图①表示石墨与氧气反应过程中的能量变化,则石墨的燃烧热为110.5 kJ·mol-1
B. 图②是用惰性电极电解NaOH溶液的电解池,阴、阳两极产生气体的体积之比为1:1
C. 图③表示常温下稀释HA、HB两种酸的稀溶液时,溶液 pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
D. 图④表示压强对可逆反应2A(g) + 2B(g)  3C(g)+D(g)的影响,甲的压强大
3C(g)+D(g)的影响,甲的压强大
10. 某溶液中大量存在的离子仅有:Fe3+、SO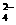 和M离子,且Fe3+、SO
和M离子,且Fe3+、SO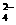 和M离子的物质的量之比为3:4:1,则M离子可能是( )
和M离子的物质的量之比为3:4:1,则M离子可能是( )
A. Cl- B. I- C. S2- D. Na+
9. 四种元素在元素周期表中的相对位置为 ,其中W的一种原子是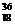 W,则下列判断中错误的是
W,则下列判断中错误的是
A. 原子半径:X<Y<Z B. 气态氢化物的稳定性:X>Y>Z
C. 氢态氢化物的还原性:X>Y>Z D. 最高价氧化物对应水化物的酸性:X>Y>Z
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com