
题目列表(包括答案和解析)
29. (17分)某化学兴趣小组在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究:
(17分)某化学兴趣小组在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究:
[实验一]探究浓硫酸的氧化性
将浓H2SO4和铜粉分别放入右图所示的分液漏斗和圆底烧瓶中,加热装置甲(夹持和加热装置省略)。
(1)写出装置甲中发出反应的化学方程式:
。
(2)品红溶液的作用是 。
(3)装置丁中的试剂是 。
[实验二]探究硫酸亚铁固体是否变质
(4)请你帮助该化学兴趣小组完成如下实验方案:
|
实验操作 |
预期现象和结论 |
|
往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液 |
|
[实验三]用KHSO4制取H2O2并测其质量分数
查阅资料得知,工业上用电解饱和KHSO4溶液制取H2O2,制取过程如下图所示:

某同学用此法制取一定浓度的H2O2溶液,并进行下列实验测定H2O2的质量分数:
离子方程式2MnO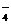 + 5H2O2 + 6H+ =2Mn2+ + 8H2O
+ 5O2↑
+ 5H2O2 + 6H+ =2Mn2+ + 8H2O
+ 5O2↑
步骤①:取5.00 mLH2O2溶液(密度为1.00g·mL-1)置于锥形瓶中并加水稀释,再加稀硫酸酸化。
步骤②:用0.1000mol·L-1的KMnO4溶液滴定。
步骤③:用同样方法滴定三次,消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL。
(5)电解饱和KHSO4溶液时,阴极的电极反应式为 。
(6)H2O2溶液中溶质的质量分数为 。
28. (15分)中学化学中某些常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去)。
(15分)中学化学中某些常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去)。
已知:A的溶液呈蓝绿色;C为黄绿色气体;D为应用最广泛的金属;K为红棕色气体;G为红褐色沉淀。
请回答下列问题:
(1)A的化学式为 ,K中所含的化学键为 。
(2)由B与浓HNO3反应生成K的化学方程式为 。
(3)由E生成F的离子方程式为 。
(4)为实现H→D的变化,若X是生活中常用的非金属单质,则X可能是 (填化学式);若X是生活中常用的金属单质,请写出反应H→D的化学方程式:
。
27.(14分)科学家一直致力于“人工固氮”的新方法研究,目前合成氨工业的核心反应是:
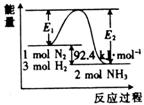 N2 (g) + 3H2 (g)
N2 (g) + 3H2 (g)  2NH3(g);
2NH3(g); =Q kJ·mol-1。反应过程中能量变化如图所示,请回答下列问题:
=Q kJ·mol-1。反应过程中能量变化如图所示,请回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化:
E1 ,E2 。(填“增大”或“减小”)
(2)在5000C、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量 (填“大于”、“小于”或“等于”)46.2kJ。
(3)在恒温恒压下,欲提高合成氨反应中H2的转化率,下列措施可行的是 (填字母)
A. 向容器中按比例再充入原料气 B. 向容器中再充入一定量H2
C. 使用新型催化剂 D. 分离出氨
(4)根据最析“人工固氮”的研究报道,在常温常压、光照条件下,N2在催化剂(掺有少量的Fe2O3的TiO2)表面与水发生反应:N2 (g) + 3H2O(l)  2NH3(g) +
2NH3(g) + 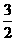 O2 (g);
O2 (g); kJ·mol-1。进一步研究NH3生成量与温度的关系,在常压下达到平衡时测得部分实验数据如下表:
kJ·mol-1。进一步研究NH3生成量与温度的关系,在常压下达到平衡时测得部分实验数据如下表:
|
T/K |
298 |
313 |
323 |
|
NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
 ①此合成反应中的a (填“>”、“<”或“=”)0。
①此合成反应中的a (填“>”、“<”或“=”)0。
②若改变实验条件(温度、压强、催化剂)得到NH3生成量随时间变化的曲线1、2、3(如图所示),则曲线1、2、3所对应的实验条件改变分别是:1. ,2. ,3. 。
13. 根据下表所提供的数据,判断物质的量浓度均为0.1 mol·L-1的HClO和CH3COOH的混合溶液中,各种粒子浓度的关系不正确的是( )
|
化学式 |
CH3COOH |
HClO |
|
物质的量浓度(mol·L-1) |
0.1 |
0.1 |
|
pH |
3 |
6 |
A. c(CH3COOH) + c(CH3COO-) = 0.1 mol·L-1 B. c(CH3COOH) > c(ClO-)
C. c(H+)=c(ClO-) + c(CH3COO-) + c(OH-) D. c(CH3COOH) > c(HClO)
12. 右图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和饱和硫酸铵溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是( )
右图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和饱和硫酸铵溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是( )
A. 铁丝在两处的腐蚀速率:a<b
B. a、b两处相同的电极反应式为Fe-2e-=Fe2+
C. 一段时间后,a处液面高于b处液面
C. 生铁丝中的碳在a、b两处分别作原电池的负极和正极
11. X、Y、Z均为短周期元素,Z的原子序数等于X、Y的原子序数之和,Z的原子最外层电子数为奇数,且Z的阴离子比X的阳离子多三个电子层,下列推断中不正确的是( )
A. Y的原子半径大于Z的原子半径 B. X可能为金属元素
C. Y一定为非金属元素 D. Z一定位于第三周期
10. 某1.2 mol ·L-1 Fe2 (SO4) 3和2.4 mol·L-1 CuSO4的混合溶液100 mL,最多能溶解铁粉的物质的量为( )
A. 0.30 mol B. 0.36 mol C. 0.48 mol D. 0.56 mol
9. 某同学进行了如图所示的实验,由实验现象得到的结论中正确的是( )

A. 原溶液中一定只含有SO B.
原溶液中一定含有SO
B.
原溶液中一定含有SO 和Cl-
和Cl-
C. 原溶液中一定只含有Cl- D.
原溶液中可能含有SO ,也可能含有Cl-
,也可能含有Cl-
8.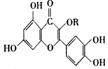 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。下列关于维生素P的叙述中错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。下列关于维生素P的叙述中错误的是( )
A. 维生素P能与溴水发生取代反应
B. 维生素P能与FeCl3溶液发生显色反应
C. 维生素P属于芳香族化合物,其分子中含有三个苯环
D. 维生素P能使酸性KMnO4溶液褪色
7. 设NA表示阿伏加德罗常数的数值,下列说法中不正确的是( )
A. 0.5 L mol·L-1 Mg(NO3) 2溶液中含有NO 的数目为2NA
的数目为2NA
B. 4.8 g由O2和O3组成的混合气体中所含氧原子数一定是0.3NA
C. 0.1 mol Fe与足量的氯气反应时失去的电子数为0.3 NA
D. 162 g纤维素[(C6H10O5) n]中所含分子数为n NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com