
题目列表(包括答案和解析)
7.用下图表示的一些物质或概念间的从属或包含关系中不正确的
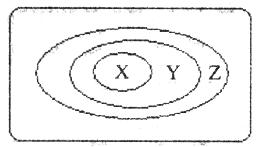
|
|
X |
Y |
Z |
|
A |
氧化物 |
化合物 |
纯净无 |
|
B |
弱电解质 |
电解质 |
化合物 |
|
C |
溶液 |
分散系 |
混合物 |
|
D |
置换反应 |
氧化还原反应 |
离子反应 |
6.下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剖
B.若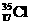 、
、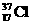 为不同的核素,有不同的化学性质
为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12L Cl2含有1.7NA个质子(NA表示阿伏加德罗常数)
5.下列叙述不正确的是
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:
D.工业上电解饱和食盐水的阳极反应:
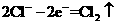
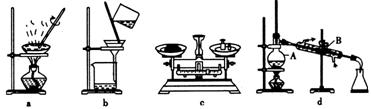
4.具备基本的化学实验技能是进行科学探究的基础和保证。下列有关实验操作正确的是
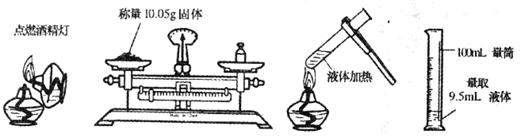
A B C D
3.广州将于2010年承办第16届亚运会。下列措施有利于节能减排、改善环境质量的有
①在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
③加速建设地铁、轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放
④发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
A.①②③④ B.①②⑤ C.①②④⑤ D.③④⑤
2.在一无色未知溶液中检验出有Ba2+、Ag+同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu2+ ②Fe3+ ③ ④
④ ⑤
⑤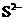 ⑥
⑥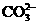 ⑦
⑦ ⑧Mg2+⑨Al3+ ⑩
⑧Mg2+⑨Al3+ ⑩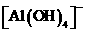 离子。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
离子。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
A.③⑤⑥⑦⑩ B.①②⑤⑥⑧⑨
C.③④⑦⑧⑨ D.①②③⑤⑥⑩
1.《中华人民共和国食品安全法》于2009年6月1日起实施。下列做法不利于食品安全的是
A.用聚氯乙烯塑料袋包装食品
B.在食品盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
30.(16分)21世纪是信息科学、合成科学和生命科学共同繁荣的世纪,其中对人类生活和世界经济的发展影响巨大的是信息技术和合成化学技术。下图表示的是某质子交换膜的合成方法(部份反应条件未列出):
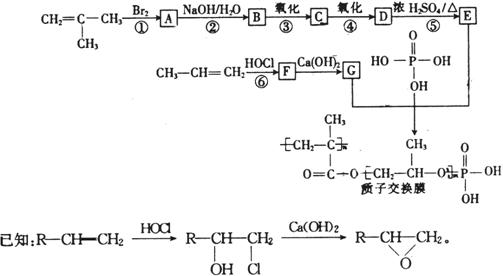
试回答下列问题:
(1)B的结构简式为 ,G的结构简式为 。
(2)反应①-⑥中,属于加成反应的是 ,E中含有官能团名称是 。
(3)写出反应②的化学方程式: 。
(4)该质子交换膜在一定条件下水解可生成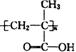 、
、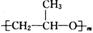 和
和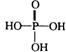 ,它们的物质的量之比为
。
,它们的物质的量之比为
。
29.(15分)为测定粗氧化铜(其中含少量氧化亚铁及不溶于酸的杂质)中CuO的质量分数,并制取无水硫酸铜,某化学活动小组进行了下列实验:
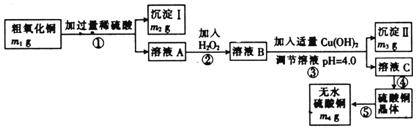
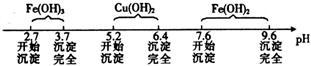
已知Fe3+、Cu2+、Fe2+三种离子在溶液中形成氢氧化物沉淀的pH范围如下:
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是 (填字母),装置d中仪器A和B的名称分别为 。
(2)溶液A中所含溶质的化学式为 。
(3)步骤②发生反应的离子方程式为 。
(4)沉淀II的化学式为 。
(5)粗氧化铜样品中CuO的质量分数为 。(列出计算式)
28.(15分)应用化学反应需要研究化学反应的条件、速率和进行的程度。
(1)金属与不同浓度的硝酸反应时,往往生成多种不同价态还原产物。图甲是各种不同密度的硝酸与铁反应时(相同温度)还原产物的分布图。
①某硝酸试剂瓶的标签注明:密度1.26g·mL-1,质量分数50.0%。若取该试剂10mL配成1000mL溶液(250C),所得溶液的物质量浓度为 。
②当硝酸溶液的密度为1.36g·mL-1时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是 (填字母)
a. 2Fe + 10 HNO3 = 2Fe(NO3) 3 + NO↑+ 3NO2↑+ 5H2O
b. 4Fe + 18 HNO3 = 4Fe(NO3) 3 + 3NO↑+ 3NO2↑+ 9H2O
 c. 2Fe + 6 HNO3 = 2Fe(NO3)2 + NO↑+
NO2↑+ 3H2O
c. 2Fe + 6 HNO3 = 2Fe(NO3)2 + NO↑+
NO2↑+ 3H2O
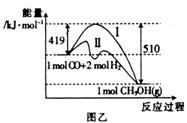
(2)在773K、体积固定的容器内,反应CO(g) + 2H2 (g)  CH3OH(g)过程中能量变化如图乙,其中曲线II表示使用催化剂时的能量变化。若投入a molCO、2a molH2,平衡时能生成0.1a molCH3OH,则反应就有工业应用价值。
CH3OH(g)过程中能量变化如图乙,其中曲线II表示使用催化剂时的能量变化。若投入a molCO、2a molH2,平衡时能生成0.1a molCH3OH,则反应就有工业应用价值。
①若按上述投料比使该反应具有工业应用价值,则CO的平衡转化率最小为 。
②下列有关催化剂的说法中正确的是 (填字母)
a. 使用催化剂,能使反应CO(g) + 2H2 (g)  CH3OH(g)的
CH3OH(g)的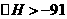 kJ·mol-1
kJ·mol-1
 b. 使用催化剂,能够提高反应物的转化率
b. 使用催化剂,能够提高反应物的转化率
c. 使用催化剂,能够提高单位时间内CH3OH的产量
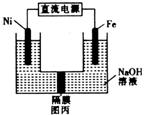
|
①Fe电极作 (填“阴极”或“阳极”)。
②Ni电极的电极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com