
题目列表(包括答案和解析)
3、 下列描述中,不符合生产实际的是
A、电解熔融的氧化铝制取金属铝,用铁作阳极
B、电解法精炼粗铜,用纯铜作阴极
C、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D、在镀件上电镀锌,用锌作阳极
2、下列叙述正确的是 A、直径介于1nm-100nm之间的微粒称为胶体
B、电泳现象可证明胶体属电解质溶液 C、利用丁达尔效应可以区别溶液与胶体
D、胶体粒子很小,可以透过半透膜
1、 近几年一种新型的甜味剂木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中正确的是
近几年一种新型的甜味剂木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中正确的是
A.木糖醇与葡萄糖、果糖一样,不能水解,所以它也属于单糖
B.木糖醇跟新制的氢氧化铜悬浊液反应生成红色沉淀
C.木糖醇与乙醇属于同系物[
D.木糖醇是一种五元醇,可以与羧酸在一定条件下发生酯化反应
24.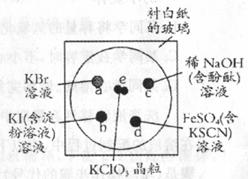 (6分)
(6分)
为了减少污染,使实验绿色化,微型实验备受青睐,下列操作是某学生做的一个微型实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各l滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。打开表面皿,向KCIO3晶体滴加一滴浓盐酸(氯酸钾与浓盐酸反应: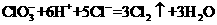 ),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式。
),再立即将表面皿盖好,试描述各处反应的现象,并写出相应的离子反应方程式。
a处 、 b处 、 c处 、


23.(11分)
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B.30.24L C.20.16L D.6.72L
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?若不可行,请说明原因。若可行,请写出反应的离子方程式
。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 。则反应中所消耗的硝酸的物质的量可能为
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。则在该反应中,H2O2的作用是 剂,该反应的化学方程式为
.
②乙同学提出,设计一个常见的实验装置,在一定条件下,不需再外加化学试剂,就能将铜溶解在盐酸中。请写出该反应的化学方程式:
,画出相应的装置图并指明电极材料。

22.(10分)
浓H2SO4和木炭在加热时发生反应的化学方程式是
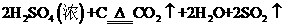
请从下图中选择所需用的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁管、铁架台及加热装置等均略去)
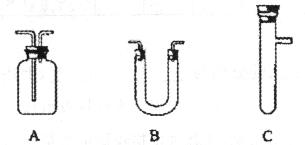
将所选的仪器按连接顺序由上至下依次填入下表,并完成表格相应内容
|
所选用仪器的名称(填字母) |
加入的试剂名称 |
该装置作用 |
|
|
|
反应器(或发生气体) |
|
|
|
检出水 |
|
|
|
检出二氧化硫 |
|
|
酸性高锰酸钾溶液 |
|
|
|
|
检出二氧化碳 |
21.(7分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)该反应的平衡常数表达式为K= ;
(2)若知上述反应为放热反应,则升高温度,其平衡常数值 (选填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= 。
(3)达到平衡后,改变某一外界条件,反应速率与时间t的关系如图:
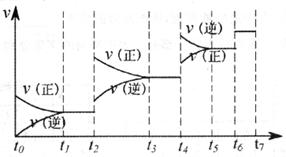
若不改变N2、CO的量,则图中t。时引起平衡移动的条件可能是 ;图中t6时引起变化的条件是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
20.(11分)
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
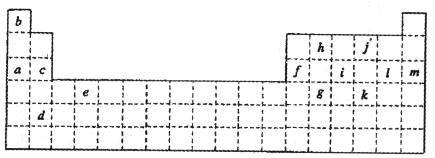
(1)写出g元素在周期表中的位置: 。
(2)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(3)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
|
最高增化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
试回答下列问题:
I.上述元素中①、②、⑥分别为 ,上述元素中处于第二周期的有 (以上均用元素符号表示)。
II.元素④与元素⑦相比较,气态氢化物较稳定的是 (填化学式)。
III.工业上获取⑤单质的主要化学反应方程式为: .
IV.⑤和⑥形成的化合物中化学键是 .
V.⑦的最高价氧化物的水化物和其氢化物反应生成的盐溶液显酸性的原因是什么?(用必要的离子方程式说明)。
19、(9分)
某同学在实验室中称取20gNaOH固体,来配制500mL 1 mol·L-1的氢氧化钠溶液。
(1)该同学准备的实验用品有:托盘天平(带砝码)、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有 ;
(2)下列有关实验操作,正确的是 ;
A.称量氢氧化钠固体时,要在天平的左右两个托盘上分别放置两个相同规格的小烧杯
B.某同学将称量的氢氧化钠固体溶解并冷却至室温,然后转移到容量瓶中
C.某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线
D.某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2-3次,并将洗涤液转移到容量瓶中
(3)在溶液的配制过程中,有以下基本实验步骤,其中,需要进行2次及以上的操作步骤是(填写操作步骤的代号) 。
①转移 ②洗涤 ③溶解 ④称量 ⑤定容 ⑥冷却
(4)玻璃棒在该实验中的作用有
① ② 。
(5)若实验室遇到下列情况,对氢氧化钠溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不蛮”)
①称量氢氧化钠时,直接放到托盘天平上称量。
②定容摇匀后,有少量溶液外流,所配溶液的浓度 。
18.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积
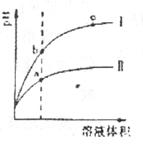 变化的曲线如右图所示。据图判断正确的是
变化的曲线如右图所示。据图判断正确的是
A.II为盐酸稀释时pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Ka的数值比c点Kc的数值大
D.b点酸的总浓度大于a点酸的总浓度
第Ⅱ卷(非选择题共54分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com