
题目列表(包括答案和解析)
3.下列试剂的贮存方法错误的是 ( )
A.苯用带橡胶塞的试剂瓶贮存 B.浓硝酸存放在棕色试剂瓶中
C.少量白磷存放在水中 D.少量金属钠存放在煤油中
2.下列家庭小实验不合理的是 ( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用纯碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
1.科学家最近又发现了一种新能源--“可燃冰”它的主要成分是甲烷与水分子的结晶水合物(CH4·nH20)。其形成:埋于海底地层深处的大量有机质在缺氧环境中,厌氧性细菌把有机质分解,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。又知甲烷同CO2一样也是温室气体。这种可燃冰的晶体类型是 ( )
A.离子晶体 B.分子晶体
C.原子晶体 D.金属晶体
24.(10分)某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种。已知常温下A、B及CO、H2的燃烧热如下:
|
物 质 |
A |
B |
CO |
H2 |
|
燃烧热/kJ·mol-1 |
725 |
5518 |
283 |
286 |
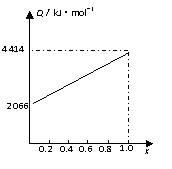 A、B按不同比例混合的燃料91.2g,在足量的氧气中燃烧时,
A、B按不同比例混合的燃料91.2g,在足量的氧气中燃烧时,
放出的热量Q与B的物质的量分数x的关系如右图。
⑴A、B的相对分子质量为A________,B_______。
⑵等物质的量的A、B混合的燃料73g,在160LO2中完全燃
烧,得到104L气体,通过碱石灰吸收后剩余3.2L(气体体
积均在标准状况下测定)。
由此可推得混合物中N(C)∶N(H)∶N(O)
=_____________________,
A分子式为__________________,B分子式为__________________。
⑶1mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980kJ,则反应中生成CO________ mol。
23.(7分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+ 10Al + 18H2O=3N2↑+ 10Al(OH)3 + 6OH-。
某化学兴趣小组的同学经过探究发现还有两条途径:
⑴金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。金属镁是从海水中提取的MgCl2通过电解制得的。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水多少kg?
⑵甲醇加人含NO3-的废水中也可消除氮的污染,其在一种微生物作用下发生反应:
6NO3- +6H+ +5CH3OH → 3N2↑ + 5CO2 ↑+ 13H2O
若某废水用上述方法处理时, NO3-→N2的转化率为a%,那么每天处理此含NO3-为b g/L的废水V m3 (密度1g/cm3) 。需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
22.(10分)在有机分析中,常用臭氧化分解来确定有机物中碳碳双键的位置与数目。如:
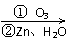 (CH3)2C=CH-CH3
(CH3)2C=O+CH3CHO
(CH3)2C=CH-CH3
(CH3)2C=O+CH3CHO
已知某有机物A经臭氧化分解后发生下列一系列的变化:
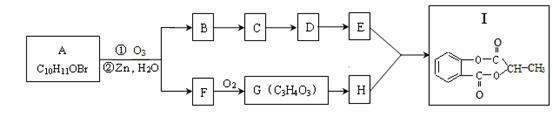
试回答下列问题:
(1)有机物A、F的结构简式为A: 、F: 。
(2)从B合成E通常要经过几步有机反应,其中最佳的次序应是 。
A.水解、酸化、氧化 B.氧化、水解、酸化
C.水解、酸化、还原 D.氧化、水解、酯化
(3)写出下列变化的化学方程式。
①I水解生成E和H: ;
②F制取G: 。
21.(10分)某二元醇A,含氧的质量分数为27.1%,其余是碳和氢。A有如下图转化关系,在转化的过程中碳原子的连接方式可能会发生变化,A、B、C、D分子结构中都有4个甲基,且均为链状结构。(已知有机物中同一个碳上连接两个羟基不稳定)
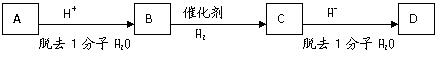
(1)A的相对分子质量是_________
(2)A和D的结构简式分别是________________和_______________________
(3)B转化为C的化学方程式是(用有机物的结构简式表示):
__________________________________________________________________
20、 (12分)现有四种系列同族元素形成的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示,
|
① |
He -268.8 |
Ne -249.5 |
Ar (x) |
Kr -151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(a) 58.7 |
I2 184.0 |
|
③ |
HF (y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O (z) |
H2S -60.2 |
(b) -42.0 |
H2Te -1.8 |
试根据上表回答下列问题
(1)a为____________色液体;b的分子式为_______________。
(2)写出②系列中物质主要化学性质的递变规律(任写一种)_______ _____
____________________;能够说明该递变规律的化学事实是_________________________
(任举一例,用离子方程式表示)。
3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是___________________________________________________________________。
(4)上表中,______和______两种物质的沸点较同系列其它物质反常,反常的主要原因是__
___________________________________________________________________________。
19. (10分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题:
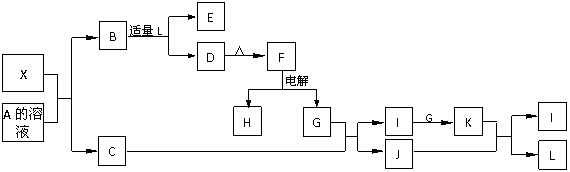
(1)写出X的化学式:__________,X属于__________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:_____________________________________。
写出K与J反应的化学方程式:_____________________________________。
(3)若B中加入足量的L,则不能生成D物质,请用离子方程式表示其原因:
。
(4)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。

 + 2N2
+ 2N2 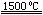 4X + SiC + 3C。
4X + SiC + 3C。
18. (10分)科学家从化肥厂生产的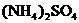 中检出组成为
中检出组成为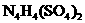 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以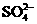 和
和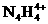 两种离子形式存在,植物的根系极易吸收
两种离子形式存在,植物的根系极易吸收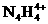 ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是______________(填序号)
A. 同种单质 B. 同位素 C. 同分异构体 D. 同素异形体
(2)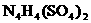 ______________(填“能”或“不能”)和草木灰混合施用:
______________(填“能”或“不能”)和草木灰混合施用:
(3)已知白磷、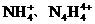 的空间构型均为四面体,
的空间构型均为四面体, 的结构式为
的结构式为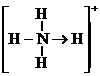 (
( 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为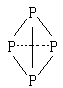
请画出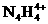 的结构式____________________________________;
的结构式____________________________________;
(4)已知液氨中存在着平衡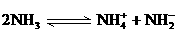 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
(5)含有一定量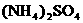 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时: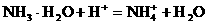
加碱时: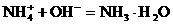
由于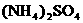 和
和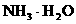 的大量存在,加少量酸或碱时,溶液中
的大量存在,加少量酸或碱时,溶液中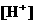 与
与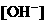 基本保持不变;
基本保持不变;
含有一定量 和
和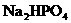 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时_____________________________________________;
加碱时_____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com