
题目列表(包括答案和解析)
21.(14分)有机物H商品名称“敌稗(Propanil)”,是一种具有高度选择性的触镣型除草剂。对稻苗安全而对稗草有很强的触杀作用。现通过下列合成路线制备H:
|
|||
 |
|
已知:
|


|
|


 II. -NO2
-NH2。
II. -NO2
-NH2。
III.当一取代苯继续发生取代反应时,新引进的取代基受到原取代基的影响而取代邻位、对位或间位。使新的取代基进入它的邻位、对位的取代基有:-CH3、-NH2、-X等;使新的取代基进入它的间位的取代基有:-COOH、-NO2等。
请结合上述所给信息,回答下列问题:
(1)写出B、D的结构简式:B ,D 。
(2)反应②和反应④的反应类型分别为 、 。
(3)有人认为:若将②、③两步反应顺序颠倒,也可以得到C。实际上是不妥的,请你指出不妥之处: 。
(4)写出反应⑤和反应⑧的化学方程式:
⑤:
 ⑧:
⑧:
(5)⑸ 与 互为同分异构体且苯环上有三个取代基的数目为 。
20. (16分)硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示)。
(16分)硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示)。
(1)图1中,A仪器的名称为 ,烧瓶中发生的离子反应方程式为
。
(2)图2是图1的改进装置,改进的目的 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法。
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,反应完全后,向其中加物质甲调节PH值到3-4,产生Fe(OH)3沉淀,过滤、蒸发、结晶、滤渣作催化剂循环使用。
己知Fe(OH)3和Cu(OH)2完全沉淀时的pH值分别为3.7、6.4请回答下列问题:
①方案1中的B仪器名称是
②方案2中甲物质是 (填字母)
a、CaO b、CuCO3 C、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL1.5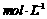 的稀硫酸中,控温在50℃,加入18mL10%的H2O2,反应0.5h后,升温到60℃,持续反应l h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.6g。
的稀硫酸中,控温在50℃,加入18mL10%的H2O2,反应0.5h后,升温到60℃,持续反应l h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.6g。
请回答下列问题:
③该反应的离子反应方程式为 。
④晶体采用酒精淋洗的优点是 。
⑤上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”)。
19.(6分)2008年5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3 反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是 ( )
A.MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是 。
18.(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
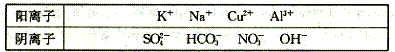
为了鉴别上述化合物。分别完成以下实验,其结果是: ( )
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
⑴写出B、D的化学式:B ,D 。
⑵将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
⑶在A溶液中加少入量澄清石灰水,其离子方程式为 。
⑷C常用作净水剂,用离子方程式表示其净水原理 。
17.(8分)某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
⑴请将Au2O3之外的反应物与生成物分别填入以下空格内。

⑵反应中,被还原的元素是_______,还原剂是____________。
⑶将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。

⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
16.有下列三个反应:①C12+FeI2 FeC12+I2 ②2Fe2++Br2 2Fe3++2Br-
③Co2O3+6HC1 2CoC12 + Cl2↑+3H2O,下列说法正确的是 ( )
A.①②③中氧化产物分别是FeC12、Fe3+、C12
B.根据以上方程式可以得到氧化性C12>Co2O3>Fe3+
C.在反应③中生成1molCl2时,有2molHC1被氧化
D.根据反应①②一定可以推理得到C12+FeBr2 FeC12+Br2
第Ⅱ卷(非选择题 共62分)
15.一定量的铁与一定量的浓HNO3反应,得到硝酸铁溶液和NO2 、N2O4 、NO的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铁溶液中加入2 mol·L-1 的NaOH 溶液至Fe3+恰好沉淀,则消耗NaOH 溶液的体积是 ( )
A.300 mL B.150 mL C.120 mL D.90 mL
14.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是 ( )

13.在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为b moL。下列叙述中正确的是 ( )
A.溶质的质量分数为ω=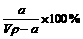
B.溶质的物质的量浓度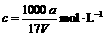
C.溶液中c(OH-)=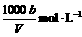
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
12.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
①18g D2O含有的电子数为10NA;
②1mol Na2O2与水完全反应时转移电子数为2NA ;
③6.8g熔融的KHSO4中含有的阳离子数为0.05 NA
④在标准状况下,22.4LSO3的物质的量为1mol;
⑤7.8g过氧化钠中含有的离子数为0.3NA;
⑥由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
⑦200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
⑧1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
⑨标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
⑩S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
A.③⑤⑥⑩ B.①③⑤⑧ C.②④⑥⑦ D.③④⑤⑨
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com