
题目列表(包括答案和解析)
12.关于下列图示的说法中正确的是 ( )
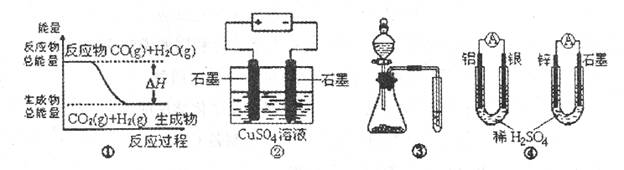
 A.图①表示C0(g)+H2O(g) CO2(g)十H2(g)是放热反应
A.图①表示C0(g)+H2O(g) CO2(g)十H2(g)是放热反应
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1
C.图③实验装置可一次而又科学准确的完成比较Cl2、Br2、I2单质氧化性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
11.常温下,c(H+)=0.1 mol·L-1的无色透明溶液中,下列各组离子一定能大量共存的
A.NH4+、Mg2+、SO42-、Cl- B.Mg2+、I-、NO3-、SO42-
C.K+、MnO4-、SO42-、Cl- D.Na+、K+、NO3-、CO32-
10.实验室制C12的反应为4HCl(浓)十MnO2 MnCl2+C12↑+2H2O。下列说法错误的是 ( )
A.还原剂是HCl,氧化剂是MnO2
B.每生成1 molCl2,转移电子的物质的量为2 mol
C.每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
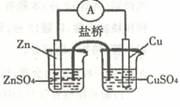
9.关于右图所示的原电池,下列说法正确的是
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H+ + 2e- = H2↑
8.NA代表阿伏加德罗常数,下列说法不正确的是
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1 L0.5mol/LNa2CO3溶液中含有的CO32-数目为0.5NA
C.标准状况下,2.24L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA
 D.0.1mol CH4所含的电子数为NA
D.0.1mol CH4所含的电子数为NA
7.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
① 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
③ 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④ 根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
33.(16分)一包白色粉末中一定含有碳酸钠,可能还含有硫酸钠、氯化钠中的一种或两种,为进一步确认白色粉末的成份,某兴趣小组对白色粉末样品进行了探究。
可选用的仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹
可选用的药品:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2 、0.1 mol·L-1Ba(NO3)2、蒸馏水。
以下是实验探究过程:
1)提出假设:
假设1 白色粉末为 的混合物;
假设2 白色粉末为 的混合物;
假设3 白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是:
。
(2)基于假设3,请根据实验方案,将实验操作和预期的现象及结论填入下表中:
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
有气体产生,说明样品中含有Na2CO3。 |
|
② |
向试管中加入0.1 mol·L-1的Ba(NO3)2 溶液。若有沉淀产生,则继续加入0.1
mol·L-1Ba(NO3)2至过量。 |
|
|
③ |
若②操作无沉淀,则向试管中加入0.1 mol·L-1AgNO3 溶液。若②操作中有沉淀,则将试管静置片刻后,取上层清液于另一去试管中,加入0.1 mol·L-1AgNO3溶液。 |
|
32.(16分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
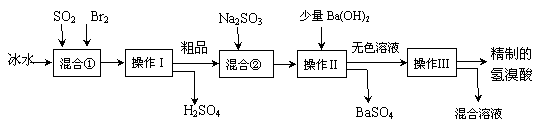
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为 。
31.(16分)工业上可利用煤的气化产物(水煤气)合成二甲醚。
⑴ 煤的气化的主要化学反应方程式为:_____________________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+
CO(g) CH3OH(g) ΔH = -90.8
kJ·mol-1
CH3OH(g) ΔH = -90.8
kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH= -41.3
kJ·mol-1
CO2(g)+ H2(g) ΔH= -41.3
kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
30.(16分)以乙烯为原料合成化合物C的流程如下所示:
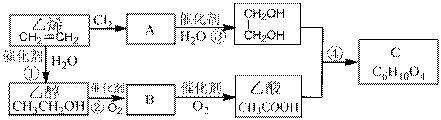
(1)请写出B和C中含有的官能团名称分别为: , 。
(2)写出A的结构简式 。
(3)①③的反应类型分别为 反应和 反应。
(4)写出乙醇的同分异构体 。
(5)写出反应②和④的化学方程式:
② ;
④ 。
(6)写出B与新制氢氧化铜悬浊液反应的化学方程式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com