
题目列表(包括答案和解析)
33.(16分)
(1) (3分)
(2) Fe(NO3)3 + KClO + KOH → K2FeO4 + KNO3 + KCl + H2O (3分)
(3) (3分)
(4) (3分)
(5) ,
(合理就给分)(各2分,共4分)
32.(16分)
(1)
(4分)
(2) (2分)
(3) (任写2种)(4分)
(4) (2分) (2分)
(2分)
31.(16分)
(1)
(2) (4分)
(3)
(4) (其他每空3分)
30.(16分)
(1)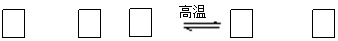
SiO2 + C+ N2 Si3N4 + CO
(2) (2分), (2分)
(3) (3分)
(4) (2分) (3分)。
33. (16分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
(16分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
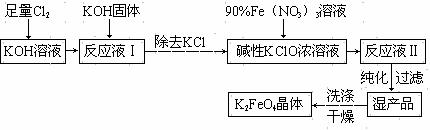
已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③ Fe(NO3)3 + KClO + KOH → K2FeO4 +KNO3 + KCl + H2O(未配平)
回答下列问题:
⑴ 该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行。
⑵ 请配平反应③:
Fe(NO3)3 + KClO + KOH → K2FeO4 + KNO3 + KCl + H2O
⑶ 配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47
g / mL),它的物质的量浓度为 。
⑷ 在“反应液I”中加KOH固体的目的是 (填字母)。
A. 与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B. KOH固体溶解时会放出较多的热量,有利于提高反应速率
C. 为下一步反应提供反应物
D. 使副产物KClO3转化为 KClO
⑸ 从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
2010-2011学年度厚德中学理科综合月考1化学试题
第二卷答题卡
32.(16分)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
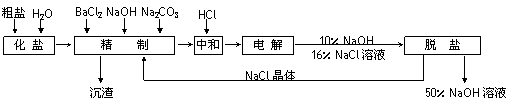
(1)精制过程中反应的离子方程式为______________________________________________________ (任写2个)。
(2)电解过程的总反应方程式为_________________________________________。
(3)电解槽阳极产物可用于________________________________(至少写出两种用途)。
(4)已知NaOH、NaCl在水中的溶解度数据如下表:
|
温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
NaOH /g |
109 |
118 |
129 |
146 |
177 |
300 |
313 |
318 |
337 |
|
NaCl/ g |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
根据上述数据,脱盐的主要工序应为_______________、_______________。脱盐后的碱液含NaOH约50%,含NaCl仅约2%左右,NaCl能够从溶液中大量析出的原因是________
______________________________________________________________________。
31.(16分)钛被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。
请填写下列空白:
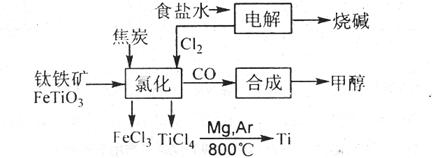
(1)电解食盐水时,总反应的离子方程式是 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
。
(3)已知:①.Mg(s)+Cl2(g)=MgC12(s) △H=-641kJ·mol-1
②Ti(s)+2C12(g)=TiCl4(s) △H=-770kJ·mol-1
则2Mg(s)+TiCl4(s)=2MgCl2(s)十Ti(s) △H= 。
|
反应2Mg(s)+TiCl4(s) 2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是
。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是 。
30.(16分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
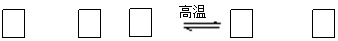
SiO2 + C+ N2 Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应产生标准状况下11.2升CO气体,则电子转移 摩尔。
(4)若有1摩尔焦炭与足量的SiO2、氮气反应,电子转移 (填大于、等于或小于)2摩尔,理由是 。
23.下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液Ca2+ + HCO3- + OH-=== CaCO3 ¯ + H2O
B.碳酸钠溶液与醋酸反应 CO32- + 2H+ = CO2↑+ H2O
C.Ca (ClO)2溶液中通入过量的二氧化硫气体 ClO- + H2O + SO2 = HSO3-+ HClO
D.足量硫化氢气体通入硫酸铁溶液中:H2S+2Fe3+=2Fe2++S↓+2H+
22.下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1
则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量
C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定
D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com