
题目列表(包括答案和解析)
6.下列有关节约保护水资源的说法中错误的是 ( )
A.硫酸工业污水必须经过净化处理,达标后才能排放
B.推广使用无磷洗衣粉主要是为了防止水体富营养化
C.目前废旧电池的回放,主要是为了防止电池中NH4Cl对水资源的污染
D.用喷灌、滴灌的主法浇灌园林,能达到节约用水的目的
25.(共8分) 在密闭容器中,放入碳酸氢钠和氢氧化钠固体共20.8g,将容器加热至
200℃,经充分反应后,排出其中气体,冷却后称得剩余固体的质量为15.9g,问原容器内碳酸氢钠和氢氧化钠各多少克?
浙师大附中2010学年第一学期十月份月考
24.(共12分)在标准状态下,分别向甲、乙、丙三个容器中加入30.0mL同浓度的盐酸,再加入不同质量的由两种金属组成的合金粉末,测量放出气体的体积。若甲、乙、丙三个容器中加入与盐酸同体积同浓度的NaOH溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积。数据如表所示
|
反应容器 |
甲 |
乙 |
丙 |
|
加入合金粉末的质量/g |
0.510 |
1.53 |
3.57 |
|
与盐酸反应生成气体的体积/L |
0.56 |
0.672 |
0.672 |
|
与NaOH反应生成气体的体积/L |
0.336 |
x |
y |
(1)根据表中数据可以计算得出的是( )
A.合金的成分和含量 B.合金的密度
C.盐酸的物质的量浓度 D.盐酸的密度
能计算出的量的值为 。
(2)若两种金属是下列选项中的某两种,则从表中的实验数据分析:
①不经计算就可判断,肯定没有 (填字母符号)
A.Ca B.Fe C.Cu D.Mg E.Al
②通过计算讨论推测合金的成分为 。
(3)根据(2)的推测结果,计算x= ,和y= 。
23、(共9分)实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
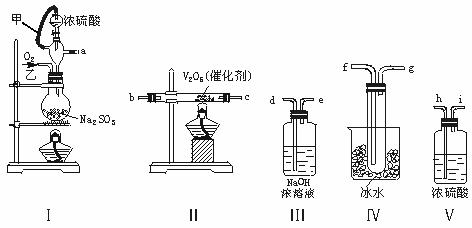
(1)这些装置的连接顺序(按气体左右的方向)是 → →
→ → → → → (填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2
一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
22、(共5分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
.⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________,反应的离子方程式为_________________________________。
⑶实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
|
|
|
③B+D===2KCl+MnO2+C↑
⑴ 写出 A、B的化学式:A ;B 。 ⑵ 第①步反应中,氧化产物是 ,被还原的元素是 。 ⑶ 第③步反应的化学方程式为 。
20、(共7分)将等质量的铜、锌、铁三种金属的混合物A克,加入FeCl3和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有(不考虑水电离产生的H+下同)________,可能还有_____。
(2)若剩余固体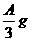 则溶液中的阳离子一定有_____________,
则溶液中的阳离子一定有_____________,
可能含有_________, 一定没有_____________。
(3)若剩余固体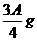 则溶液中的阳离子一定有_______,一定没有________。
21、(共7分)下图是部分常见元素的单质及化合物的转化关系图(有关反应的条件及部分生成物已略去)
则溶液中的阳离子一定有_______,一定没有________。
21、(共7分)下图是部分常见元素的单质及化合物的转化关系图(有关反应的条件及部分生成物已略去)
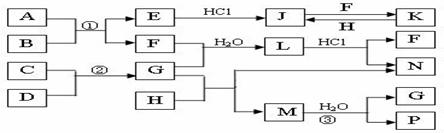

已知:E为红色固体,K为浅绿色溶液;反应①、②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A化学式是 。
(2)L的化学式 ;G的水溶液中,最多的阳离子是 。
(3)写出J与F反应的离子方程式: 。
(4)写出G与H反应生成M和N的化学方程式: 。
18、在100mL盐酸、硝酸的混合酸中,HNO3的物质的量浓度为0.2mol/L,HCl的物质的量浓度为0.1mol/L.向其中加入0.96g铜粉微热,待充分反应后,溶液中Cu2+的物质的量浓度约为
A、 0.075mol/L B、 0.1125mol/L C、 0.15mol/L D、0.225mol/L
第Ⅱ卷(非选择题,共54分)
17、今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如表1所示(假定反应前后溶液体积不变):
|
组别 |
甲 |
乙 |
丙 |
丁 |
|
V[FeCl3(aq)]/mL |
100 |
100 |
100 |
100 |
|
混合粉末质量/g |
6 |
13.2 |
24 |
36 |
|
反应后剩余固体质量/g |
0 |
1.28 |
12.8 |
24.8 |
下列结论正确的是
①第甲组溶液中c(Fe3+)=3.0mol/L ②第乙剩余固体全是铜;第丙组剩余固体是铁和铜。
③第丁组反应后滤液中c(Fe2+)=6.0mol/L ④原混合粉末中n(Fe):n(Cu)=3:2
⑤第丁组反应后剩余固体中n(Fe):n(Cu)=1:3
A.①② B.②③ C.③⑤ D.④⑤
16、部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+ ②样品中Fe元素的质量为2.24 g
③样品中Fe元素的质量为2.49 g ④样品CuO的质量一定为0.80 g ⑤V=448 ⑥ V=896
A、② B、②④⑤ C、①③⑥ D、②⑤
15、向2毫升0.5摩/升的 FeC13溶液中加入3毫升5摩/升的 KF溶液,发现 FeC13溶液渐渐褪至无色,再加入 KI溶液和 CC14振荡后,静置,不见 CCl4层有紫红色,则下列说法正确的是
A、Fe3+不与I-发生反应 B、Fe3+与 F-结合成不与 I-反应的物质
C、F-使 I-的还原性减弱 D、Fe3+被 F-还原为 Fe2+,使溶液中不再存在 Fe3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com