
题目列表(包括答案和解析)
27.(16分)将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体。根据下图回答:
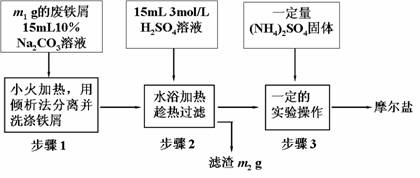
(1)步骤1中Na2CO3的主要作用是
(2)步骤2中溶液趁热过滤的原因是
(3)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:
加热蒸发、 、 。
(4)三个步骤中都含有固液分离的操作,其中步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有
A、沉淀的颗粒较大 B、沉淀容易沉降 C、沉淀呈胶状 D、沉淀呈絮状
(5)制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
Fe2+ + MnO4-+( ) - Mn2+ + Fe3+ + H2O
②本实验的指示剂是 。
A、酚酞 B、甲基橙 C、石蕊 D、不需要
③产品中Fe2+的质量分数为 。
26.(13分)某溶液仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
|
阳离子 |
Na+ Mg2+ Fe3+ Al3+ Fe2+ |
|
阴离子 |
OH-
CO32-
Cl- NO3- SO42- |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变;
请推断:
(1)原溶液中含有阳离子: ;含有阴离子: ;
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式: ;
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
25.(14分)由短周期元素组成的A、B、C、D、E、F六种粒子,其中只有C、D是分子,其余四种均是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种粒子间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,若加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1)微粒B的电子式是_____________;粒子E的名称是____________;
(2)粒子F对应的元素在周期表中的位置是_________________________________。
(3)写出下列反应的离子方程式:
F+过量C的溶液:___________________________________________________
W+含大量B离子的溶液:
(4)六种微粒中的两种可与硫酸根形成一种复盐,向该复盐的浓溶液中滴加浓苛性钠溶液,产生的现象有(未排序):①有刺激性气味气体放出 ②沉淀逐渐减少 ③溶液中出现白色沉淀④沉淀完全消失 ⑤沉淀逐渐增多
该复盐的化学式为 ,产生的现象正确的排序是____ _______
13.已知氧化还原反应:15CuSO4 + 11P + 24H2O = 5Cu3P + 6H3PO4 +15H2SO4,其中1mol P作还原剂,
则被还原的CuSO4的物质的量为
A. 15/11 B. 5/2 C. 5 D.3
12.常温常压下,将a mol CO2气体通入1L 1 mol·L-1的NaOH溶液中,下列对所得溶液的描述不正确的是
A.当1/2<a <1时,所得溶液中存在: c(Na+) >c(CO32-)+ c(HCO3-)+ c(H2CO3)
B.当a=1时,所得溶液中存在:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3)
C.当a=1/2时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D.当a=1时,所得溶液中存在:c(Na+) >c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
11.以惰性电极电解一定浓度的CuSO4溶液,一段时间后取出电极,加入9.8 g Cu(OH)2后溶液与电解前相同,则电解时电路中流过的电子为
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
10.下列离子方程式正确的是
A.过量氯气通入碘化亚铁溶液中: Cl2+Fe2++2I-=2Cl-十Fe3+ +I2
B.向NaHCO3溶液中加入少量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.H218O中投入少量Na2O2固体:2H218O+2 Na2O2=4Na++4OH-+18O2↑
D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:
H+ +SO42-+Ba2+ +OH-==BaSO4↓+ H2O
9.下列有关实验原理或操作正确的是
A.洗涤沉淀时,向漏斗中加适量水,搅拌并滤干
B. 仅用硝酸银溶液便可鉴别亚硝酸钠和食盐
C.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸
D.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
8.NA为阿伏加德罗常数,下列叙述正确的是
A.通常状况下,80g SO3所含有的分子数目为NA
B.含NA个Na+ 的Na2O溶解于1 L水中,Na+ 的物质的量浓度为1 mol·L-1
C.30 g SiO2 晶体中含有NA个Si-O键
D.在反应KIO3 + 6 HI = KI +3 I2 + 3 H2O中,每生成0.5 mol I2转移的电子数为 3NA
7.化学与生活密切相关,下列有关说法正确的是
A. 光导纤维、蛋白质、油脂、淀粉都是由高分子化合物组
成的物质
B. 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分
C.用食醋除去水壶中的水垢时所发生的反应是水解反应
D.血红蛋白、蚕丝、过氧化氢酶、人造奶油充分水解均可得到氨基酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com