
题目列表(包括答案和解析)
9、 短周期元素X、Y的原子序数相差2,下列叙述正确的是( )
A.X与Y不可能位于同一周期
B.X与Y不可能形成原子个数比为1:1型离子化合物
C.X离子与Y离子电子层结构可以相同,也可以不同
D.X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构
8、A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A. B、A、D、C、E B. E、C、D、B、A
C. A、B、C、D、E D. C、D、A、B、E
7、下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是( )
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液
③少量的电石加到过量的NaHCO3溶液中 ④ Na2O2投入FeCl2溶液中
⑤浓硫酸铵溶液加入到浓氢氧化钡中
A.①④ B.②③ C.①③④⑤ D.①③④
6、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:2Fe(OH)3+3ClO―+4OH―=2FeO42-+3Cl―+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
下列有关说法不正确的是( )
A.高铁酸钾中铁显+3价
B.湿法中每生成1mol Na2FeO4转移3 mol电子
C.干法中每生成1mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质
5. 为了实现流域环境的治理,甲、乙两相邻的工厂进行横向联合排污,已知两厂排放的污水经初步处理后,还溶有较大浓度的
为了实现流域环境的治理,甲、乙两相邻的工厂进行横向联合排污,已知两厂排放的污水经初步处理后,还溶有较大浓度的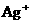 ,
,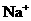 ,
,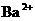 ,
,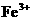 ,
, ,
, ,
, ,
,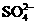 中各不相同的四种离子,若单独排放仍会造成环境污染,如果两厂的污水按适当比例混合,经沉淀后污水变成硝酸钠溶液,下列判断正确的是( )
中各不相同的四种离子,若单独排放仍会造成环境污染,如果两厂的污水按适当比例混合,经沉淀后污水变成硝酸钠溶液,下列判断正确的是( )
A. 和
和 一定来自不同的工厂 B.
一定来自不同的工厂 B.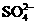 和
和 可能来自同一工厂
可能来自同一工厂
C.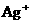 和
和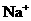 可能来自同一工厂 D.
可能来自同一工厂 D.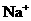 和
和 可能来自同一工厂
可能来自同一工厂
4、有一未完成的离子方程式为:□□+XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为( )
A.+7 B. +4 C.+5 D.+1
3.关于反应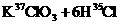

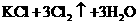 的有关叙述中,正确的是( )
的有关叙述中,正确的是( )
A.KCl中含有 B.KCl中含有
B.KCl中含有
C.生成物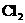 的相对分子质量为71g/mol D.该反应转移电子数为
的相对分子质量为71g/mol D.该反应转移电子数为
2.向5 mLNaCl溶液里滴入一滴AgNO3溶液,出现白色沉淀,继续加入一滴KI溶液,沉淀变为黄色,再加入一滴Na2S溶液,沉淀又变为黑色,据此分析此三种沉淀物的KSP的一般关系为( )
A.KSP(AgCl)= KSP (AgI)= KSP (Ag2S) B.KSP (AgCl)<KSP (AgI)<KSP (Ag2S)
C.KSP (AgCl)>KSP (AgI)>KSP (Ag2S) D.因发生特殊反应,无法判断
1. 下列说法正确的是( )
下列说法正确的是( )
 A.1mol氧气中含有12.04x1023 个氧原子,标准状况下体积为44.8L
A.1mol氧气中含有12.04x1023 个氧原子,标准状况下体积为44.8L
 B. 1mol臭氧和1.5mol氧气所含有氧原子的质量相同
B. 1mol臭氧和1.5mol氧气所含有氧原子的质量相同
 C.等体积,浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3 :1
C.等体积,浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3 :1
 D.等物质的量的干冰和葡萄糖所含碳原子数之比为1 :6,氧原子数之比为2 :3
D.等物质的量的干冰和葡萄糖所含碳原子数之比为1 :6,氧原子数之比为2 :3
28.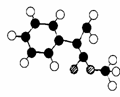 (15分)肉桂酸甲酯(
(15分)肉桂酸甲酯(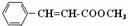 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
(1)肉桂酸甲酯的分子式是 ;
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图
中球与球之间连线表示单键或双键)。G的结构简式为 ;
(3)用芳香烃A为原料合成G的路线如下:
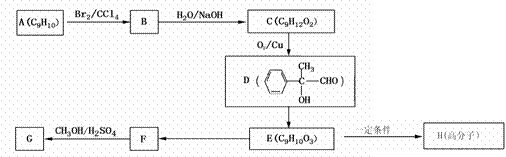
① 化合物E中的官能团有 (填名称)。
② B→C的反应类型是 ,E→H的反应类型是 ;
③书写F→G化学反应方程式: 。
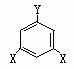 ④E的同分异构体有多种,试写出3种符合下列三个条件的同分异构体的结构简式:
④E的同分异构体有多种,试写出3种符合下列三个条件的同分异构体的结构简式:
、 、
ⅰ.符合如右图所示的通式(其中X、Y均不为氢)
ⅱ.能发生银镜反应 ⅲ.能与钠反应放出H2
自选模块
题号:15
“化学与生活”模块(10分)
请在标有序号的空白处填空,并将序号及相应答案写在答题纸上。
食品关系国计民生,请回答下面与食品相关的问题。
(1)衢州脐橙每100mL橙汁中平均含水87.0g,糖类12.0g,柠檬酸0.95g,蛋白质0.9g,脂肪0.2g,维生素0.08g,钙、铁、磷、锌等元素1.8g。除水、无机盐、蛋白质和维生素外,橙汁中含有的营养素还有 ① 。
(2)人们从植物油中摄取的亚油酸是CH3(CH2)3(CH2CH=CH)2(CH2)7COOH对人体健康是十分有益的,下列关于亚油酸的说法不正确的是 ② 。
A.分子式为C18H34O2 B.在食用油中亚油酸通常是以甘油酯的形式存在
C.亚油酸是一种不饱和的脂肪酸 D.亚油酸和甘油反应生成的酯是高分子化合物
(3)在日常生活中我们可以采用菜肴合理搭配的方法补充人体必需的元素,以下进补办法你认为不合理的是 ③ 。
A.缺碘可以食用加碘盐 B.适当多吃鸡蛋、猪肝和精肉可补铁
C.适当多吃鱼类可补充N、C、P、O、H等元素
D.如果贫血,应吃大量的猪肝,并要服用过量的补铁剂
(4)味精是我们常用的鲜味剂,在使用时要注意的问题是: ④ 。
(5)苯甲酸(C6H5COOH)是一种弱酸, 在水溶液中发生电离,存在如下化学平衡:
C6H5COOH  C6H5COO-+H+ 。苯甲酸的防腐作用主要依赖于溶液中未电离的分子,运用化学平衡的知识可知,一般情况下在 ⑤ (填“酸”或“碱”)性溶液中苯甲酸的防腐作用比较好。
C6H5COO-+H+ 。苯甲酸的防腐作用主要依赖于溶液中未电离的分子,运用化学平衡的知识可知,一般情况下在 ⑤ (填“酸”或“碱”)性溶液中苯甲酸的防腐作用比较好。
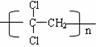 (6)聚偏二氯乙烯(如右图)具有超强的阻隔性能,可作为食品的包装材料。
(6)聚偏二氯乙烯(如右图)具有超强的阻隔性能,可作为食品的包装材料。
它是由 ⑥ (写出结构简式)单体发生加聚反应生成的。若以乙炔为原料,通过加成反应生成1,1,2一三氯乙烷,再在一定条件下反应可生成这种单体,则在上述加成反应中宜选择的加成试剂有 ⑦ 。
A.HCl B.Cl2 C.HClO D.NaCl
题号:16
“化学与技术”模块(10分)
请在标有序号的空白处填空,并将序号及相应答案写在答题纸上。
自来水生产的流程示意图见下:
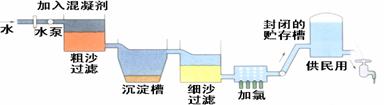
⑴ 混凝剂除去悬浮物质的过程 ①
A.只是物理变化 B.只是化学变化 C.是物理和化学变化
⑵ FeSO4·7H2O是常用的混凝剂,它在水中最终生成 ② 沉淀。
⑶ 我们有时感觉自来水“有漂白粉气味”是因为使用了氯气消毒。 下列物质中不能作为氯气代用品的有 ③
A.臭氧 B.ClO2 C.K2FeO4 D.SO2
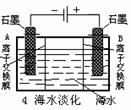 ⑷有些地区需要海水淡化得到淡水。用阴、阳离子交换树脂软化海水时,先把水通过装有 ④ (填“阴”或“阳”)离子交换树脂的离子交换柱,然后再通过装有 ⑤ (填“阴”或“阳”)离子交换树脂的离子交换柱。
⑷有些地区需要海水淡化得到淡水。用阴、阳离子交换树脂软化海水时,先把水通过装有 ④ (填“阴”或“阳”)离子交换树脂的离子交换柱,然后再通过装有 ⑤ (填“阴”或“阳”)离子交换树脂的离子交换柱。
⑸还有电解法淡化海水,如图所示,电解池中间海水经过一定时间电解后,阴、阳离子浓度减少,成为符合标准的淡水。靠近阴极的A离子交换膜是 ⑥ (填“阴”或“阳”)离子交换膜。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com