
题目列表(包括答案和解析)
19、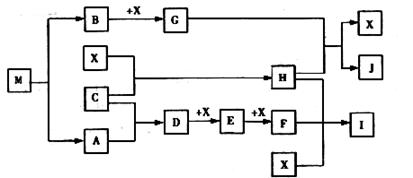 (15分)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。
(15分)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。
 ①写出D与X反应的化学方程式
①写出D与X反应的化学方程式
 ②写出G与H反应的离子方程式
。
②写出G与H反应的离子方程式
。
③实验室中I应如何保存? 。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式 。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
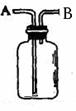
18、 (8分)右图装置的用途多种多样,有“万能瓶”之称。
(8分)右图装置的用途多种多样,有“万能瓶”之称。
 按下列要求回答问题:
按下列要求回答问题:











 (1)用该装置收集氢气,气体从
进入;(填A、B,下同)
(1)用该装置收集氢气,气体从
进入;(填A、B,下同)
 收集一氧化氮,先将瓶子注满水,塞紧瓶塞,气体从 进入,
收集一氧化氮,先将瓶子注满水,塞紧瓶塞,气体从 进入,
 (2)用该装置除去混在氯气中的氯化氢,广口瓶应装
溶液,混合气从
(2)用该装置除去混在氯气中的氯化氢,广口瓶应装
溶液,混合气从
 进入;
进入;
 (3)用该装置测量O2的体积时,将广口瓶注满水后,塞紧瓶塞,O2从 进入, 与带导管的量筒相接。
(3)用该装置测量O2的体积时,将广口瓶注满水后,塞紧瓶塞,O2从 进入, 与带导管的量筒相接。
 (4)医院里用盛蒸馏水的该装置连接氧气瓶与病人,
接氧气瓶, 与病人相接。
(4)医院里用盛蒸馏水的该装置连接氧气瓶与病人,
接氧气瓶, 与病人相接。
17、(10分)现有四种短周期元素X、Y、Z、W,其中:① X、W原子的电子层数与最外层电子数之比分别为3:1和 1:3 ② Y元素的某原子核内无中子 ③ Z元素原子的最外层电子数是其内层电子总数的2倍。回答下列问题:
(1)X元素在周期表中的位置是 。
(2)化合物X2W2的电子式是 。
(3) 向含1 mol Na2SiO3的溶液中缓慢通入2 mol的ZO2,反应的离子方程式是 。
(4)由Y、Z、W元素中的两种或三种可以组成多种分子,其中 含有18个电子的分子是 (只需填一个化学式)。
 (5)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度。向25.00
mL 的Y2Z2W4溶液中加入5.00 mL 0.50
mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是 mol/L。
(5)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度。向25.00
mL 的Y2Z2W4溶液中加入5.00 mL 0.50
mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是 mol/L。
16. 将a mol钠和a mol铝一同投入m g足量的水中,所得溶液的密度为dg·
将a mol钠和a mol铝一同投入m g足量的水中,所得溶液的密度为dg· 该溶液的质量分数为( )
该溶液的质量分数为( )

 A.
A.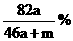 B.
B.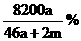
 C.
C.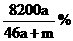 D.
D.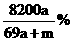
15、下列分子中,所有原子的最外层均为8电子结构的是( )
A.BeCl2 B.HClO C.PCl5 D.P4
14.下列离子方程式书写正确的是( )
A.溴乙烷与6mol/L的氢氧化钠水溶液共热:
C2H5Br+OH-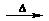 CH2=CH2↑+Br-+H2O
CH2=CH2↑+Br-+H2O
B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:
Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
CaCO3↓+CO32-+2H2O
C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸:
3Fe2++4H++NO3- 3Fe3++NO↑+2H2O
3Fe3++NO↑+2H2O
D.在H2O2中加入酸性高锰酸钾溶液:
2MnO4-+6H++5H2O2 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
13.在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.FeCl2溶液:K+、Na+、SO42-、AlO2-
D.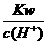 =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
12.下列有关实验操作的说法正确的是( )
A.可用25 mL碱式滴定管量取20.00 mL KMnO4 溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全
11、从下列事实所列出的相应结论正确的是( )
|
|
实
验 事 实 |
结 论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
结合H+的能力:CO32-<
AlO2- |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
10、下列反应的离子方程式正确的是( )
A.NaHS水解:HS-+H2O H3O++S2-
H3O++S2-
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
C.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
D.澄清石灰水跟盐酸反应:H++OH-=H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com