
题目列表(包括答案和解析)
15、将某碳酸钠和碳酸氢钠的混合物2.74g加热到质量不再变化时,剩余物质的质量为2.12g。求混合物中碳酸钠的质量分数。
14、我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
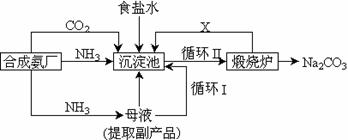

(1)上述生产纯碱的方法称 ,副产品的一种用途为 。
(2)沉淀池中发生的化学反应方程式是 。
(3)写出上述流程中X物质的分子式 。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是
A、增大NH4+的浓度,使NH4Cl更多地析出
B、使NaHCO3更多地析出
C、使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
13、有一包白色粉末,它可能由硫酸钠、碳酸钠、硝酸银中的一种或几种混合组成的。现进行实验,取白色粉末加入稀盐酸,得到澄清的溶液,并有气体放出,那么白色粉末中肯定有的是 ,肯定没有的是 ,不能确定的是 。为了把不能确定的物质断定它是否存在,那么可在澄清溶液中加入 ,若出现______现象,则能确定 存在,反之说明不存在。
12、下列离子方程式中正确的是( )
A、 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C、碳酸钠溶液中通入少量CO2:CO32-+CO2+H2O=2HCO3-
D、FeCl2溶液中通入过量Cl2:Fe2+Cl2=Fe3++2Cl-
11、下列关于钠离子的叙述中,正确的是( )
A、不能独立存在 B、比钠原子活泼 C、焰色反应呈黄色 D、具有强还原性
10、镁粉在焰火、闪光灯中是不可缺少的原料,工业上制造镁粉是将镁蒸气在气体中冷却。下列气体中,可用来冷却镁蒸气的是( )
A、空气 B、二氧化碳 C、氢气 D、氩气
9、以NA表示阿佛加德罗常数,下列说法中正确的是( )
A、53g碳酸钠中含NA个CO32- B、0.1molOH-含NA个电子
C、1.8g重水(D2O)中含NA个中子 D、标准状况下11.2L臭氧中含NA个氧原子
8、可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是( )
A、加热时无气体放出 B、滴加盐酸时有气泡放出
C、溶于水后滴加BaCl2稀溶液有白色沉淀生成
D、溶于水后滴加澄清石灰水有白色沉淀生成
7、将一定质量Mg、Zn、Al的混合物与足量稀硫酸反应,生成H2 2.8L(标准状况),则原混合物的质量可能是 ( )
A、2g B、4g C、8g D、10g
6、将相同质量的镁条分别放在①O2 ②N2 ③空气 ④CO2中燃烧,将燃烧后所得的固体产物按质量由小到大的顺序排列的是 ( )
A、②①③④ B、③②①④ C、④③②① D、②③①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com