
题目列表(包括答案和解析)
13.已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反,I2的氧化性比S强。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A.FeS、Al(OH)3和S B.Fe(OH)3和Al(OH)3
C.Fe2S3和 Al(OH)3 D.Al2S3、FeS和S
12.在给定的溶液中,加入对应的一组离子,则该组离子能在原溶液中大量共存的是( )
A.滴加甲基橙显红色的溶液:I-、NH4+、Cl-、NO3-
B.pH=13的溶液: S2-、SO32-、S2O32-、Na+
C.水电离出来的c(H+)=10-13 mol/L的溶液: K+、HCO3-、Br-、Ba2+
D.含有溶质为NaHSO4的溶液: K+、SiO32-、NO3-、Al3+
11.将H(CB11H6Cl6)与C60反应,C60得到一个质子,制得离子化合物[HC60]+[CB11H6Cl6]-。下列反应中,反应类型与之相似的是( )
A.Mg + 2HCl → MgCl2 + H2↑ B.NaOH + HCl → NaCl + H2O
C.H2O
+ CH3COOH 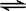 H3O+ +
CH3COO-
D.NH3 + HCl → NH4Cl
H3O+ +
CH3COO-
D.NH3 + HCl → NH4Cl
10.下列物质间反应的离子方程式正确 ( )
A.相同物质的量浓度的FeI2溶液与溴水等体积混合
2Fe2+ +2I- +2Br2 = 2Fe3++I2+4Br2-
B.Ba(OH)2溶液中加入过量的NaHSO4 溶液
Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
C.四氧化三铁溶于氢碘酸溶液中
Fe3O4 + 8H+ + 2I- = 3Fe2+ +I2 + 4 H2O
D.向漂白粉溶液中加入适量的SO2
Ca2 + 2ClO- + SO2 + H2O = CaSO3↓+ 2HClO
9.氮化钠和氢化钠与水反应的化学方程式如下:Na3N + 3H2O → 3NaOH + NH3,
NaH + H2O → NaOH + H2↑。有关Na3N和NaH的叙述正确的是( )
A.氮化钠属于盐,氢化钠属于固态氢化物
B.与水反应都是氧化还原反应
C.与盐酸反应都只生成一种盐
D.加热熔化时,都只破坏离子键
8.设阿伏加德罗常数为NA,下列说法正确的是( )
A.15.6gNa2O2与过量SO2反应时,转移的电子数为0.2NA
B.常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3 NA
C.1 mol NO2与足量H2O反应,转移的电子数为NA
D.常温下,1 L 1 mol/L CH3COONH4溶液中含量NH4+的数目为NA
7.在实验室不慎手被玻璃划破,可用FeCl3溶液紧急止血,其主要原因可能是( )
A.FeCl3溶液具有杀菌消毒作用 B.FeCl3溶液能使血液凝聚 C.FeCl3能产生Fe(OH)3胶体堵住伤口 D.FeCl3溶液能使血液发生化学变化
6.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生 Cl2,下列关于混盐CaOCl2 的有关判断不正确的是( )
A.该混盐中氯元素的化合价为零 B.该混盐具有较强的氧化性
C.该混盐的水溶液呈碱性 D.该混盐与硫酸反应产生71gCl2时转移1mol 电子
5.下列物质分类的正确组合是( )
|
分类 组合 |
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
|
A |
氢氧化钡 |
乙二酸 |
胆矾 |
氧化铝 |
二氧化氮 |
|
B |
烧 碱 |
盐酸 |
小苏打 |
氧化镁 |
一氧化碳 |
|
C |
苛性钾 |
硬脂酸 |
萤石 |
过氧化钠 |
二氧化硫 |
|
D |
苛性钠 |
油酸 |
苏打 |
氧化钠 |
三氧化硫 |
4.某同学在实验报告中写有以下实验数据:① 用托盘天平称取11.7g食盐;② 用量筒量取5.26mL的盐酸;③ 用广泛pH试纸测得某酸溶液的pH值是3.3;④ 滴定盐酸时用去23.00mLNaOH溶液,其中数据合理的是 ( )
A. ①② B. ③④ C. ①④ D. ①③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com