
题目列表(包括答案和解析)
23.(7分)某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
(1)制备硫酸亚铁溶液,最合适的试剂组为___________(填编号);
a.过量铁屑和稀硫酸 b.过量稀硫酸和铁屑 c.过量硫酸铁溶液和铁屑
(2)实验室保存硫酸亚铁溶液的一般方法是_____________________________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
|
烧杯编号 |
① |
② |
③ |
|
加入试剂 |
铁粉0.1g |
铁粉0.1g,0.1mol/LH2SO43mL |
0.1mol/LH2SO43mL |
|
红色出现时间(天) |
1天 |
4天左右 |
8天以上 |
(3)在烧杯②中加入2种试剂后,即可观察到的现象为_____________________________;
(4)通过比较上述3组实验,可以得出的结论为___________________________________;
(5)试用离子方程式表示稀硫酸酸化的硫酸亚铁溶液在空气中被氧化的过程
________________________________________;
22.(10分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料。

请填写下列空白:
⑴在周期表中,组成单质G的元素位于第______周期______族。
⑵在反应⑨中还原剂与氧化剂的物质的量之比为___________________。
⑶在反应②、③、⑥、⑧中,既属于化合反应又属于氧化还原反应的是_______(填写序号)。
⑷反应④的离子方程式是:_______________________________________。
⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:___________________
21.(11分)某兴趣小组的学生根据镁和CO2反应原理,推出钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证。某同学设计了下图装置进行实验(已知CO能还原PdCl2得到黑色的Pd),请回答下列问题:
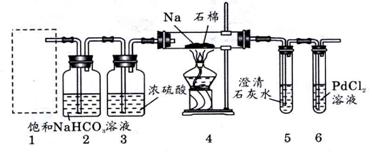
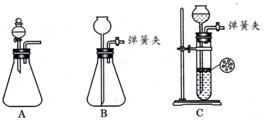
(1)为使反应随开随用,随关随停,方框内应选用下图_____装置(添字母代号)。简述该装置随关随停的理由______________________________________________________.
(2) 检查装置气密性并装好药品后,点燃酒精灯之前,应进行的操作是_______________,待装置_____(填数字编号)中出现_______________现象时,再点燃酒精灯。
(3)①若装置6中有黑色沉淀,装置4中有残留固体(只有一种物质)加盐酸后有能使石
灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_________________________.
②若装置6中出现无明显现象,装置4中残留固体(有两种物质)加盐酸后能使石灰水变浑
浊的气体放出,则钠与二氧化碳反应的化学方程式__________________________________.
(4)指导老师认为,不仅要检验残留固体中碳酸钠,还要检验其中是否有氧化钠和碳。当确认钠充分反应后,请你设计一个实验,说明装置4中得到的残留固体中是否含有Na2O和C。用文字描述。
____________________________________________________________________________
____________________________________________________________________________.
20.把铝粉与Fe3O4的混合物,分为两等份。前一份在高温下恰好完全反应,之后将生成物与足量盐酸充分反应;后一份直接加入足量NaOH溶液充分反应。前后两种情况下生成的气体在同温同压下的体积比是( )
A.4:3 B.3:4 C.9:8 D.1:1
19.向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向
反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的是( ) A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移2mol电子时生成1mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
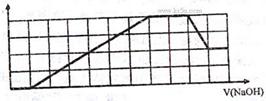
18.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如下所示,下列说法正确的是 ( )
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4
17.某固体混合物可能含有NH4Cl、KOH、AgNO3、AlCl3中的若干种,加适量水充分搅拌,得无色澄清溶液,取溶液进行如下实验:
①蘸取少量原溶液滴在pH试纸上,试纸显蓝色,与标准比色卡比较,pH约为11;
②取1mL原溶液加入3滴乙醛,水浴加热,试管内壁出现光亮的“银镜”.
根据上述实验现象,以下推测正确的是 ( )
A.肯定存在的只有KOH和AgNO3 B. NH4Cl、AlCl3肯定不存在
C.KOH和AlCl3可能存在 D.肯定存在的只有NH4Cl、KOH和AgNO3
16.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O = 3Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O = Fe3O4+4NaOH;
下列说法不正确的是 ( )
A.反应①②③均是氧化还原反应
B.反应②中的氧化剂是NaNO2
C.该生产过程会产生污染
D.整个反应过程中每有16.8g Fe参加反应转移0.8mol电子
15.室温下,将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A.加入合金的质量可能为6.4g
B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为150mL
D.溶解合金时收集到NO气体的体积为2.24L
14.20℃时有a g硫酸铜溶液V mL。将溶液蒸发掉b g水后恢复到20℃,恰好全部生成
硫酸铜晶体(CuSO4·5H2O),则下列关系式错误的是 ( )
A.原硫酸铜溶液的密度为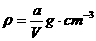
B.生成硫酸铜晶体的物质的量为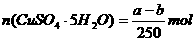
C.原硫酸铜溶液的物质的量浓度为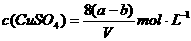
D.原硫酸铜溶液的质量分数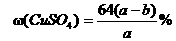
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com