
题目列表(包括答案和解析)
7.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2O2只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
6.设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.71 g氯气被还原得到的电子数为2NA
B.100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA
C.标准状况下,2.24 L苯中含有的碳原子数为0.6 NA
D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64 g金属时阳极失去的电子数小于2NA
5.下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B.③⑥ C.②④ D.⑤⑥
4、下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性: H++SO42-+Ba2++OH- = BaSO4↓+H2O
B.NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO- + 2H2O = Fe(OH)2↓ + 2HClO
C.NH4HSO3溶液与足量NaOH溶液反应:NH4+ + OH-= NH3↑ + H2O
D.将1mol/L的NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
3、下列物质中微粒的个数比不是1 : 1的是( )
A.NaHCO3晶体中的阴离子和阳离子 B.Na2O2固体中的阴离子和阳离子
C.重氢(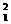 H)原子中的质子和中子 D.NH3分子中的质子和电子
H)原子中的质子和中子 D.NH3分子中的质子和电子
2.下列有关物质结构的表述正确的是( )
A.次氯酸的电子式 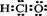 B.乙烯的分子式
B.乙烯的分子式 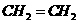

C. 碳-12原子 126C D.钠离子的结构示意图
1、若将NaOH(s)、P2O5(s)、无水CaCl2(s)归为一类。从A-D中选出一种最适宜与这三种物质归为一类的是( )
A)浓硫酸 B)氯化钠 C)碱石灰 D)生石灰
20.(12分)下图是利用石油为原料合成增塑剂G的基本流程:
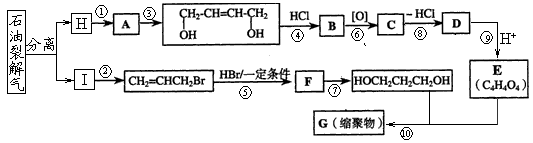
请完成下列各题:
(1)反应⑧条件是 。
(2)写出反应⑦的化学方程式: 。
(3)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(5)写出相对分子质最小,跟E互为同系物的有机物的结构简式_________________,写出G的结构简式 。
2010学年杭州学军中学高三年级第二次月考
19.(11分) 某研究性小组借助A-D的仪器装置完成有关实验
[实验一]收集NO气体。
(1)用装置A收集NO气体,正确的操作 (填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
[实验二]为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和 (填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),w(Zn) = 。
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将_____(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
(5)w(Zn) 。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(6)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
18.(10分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
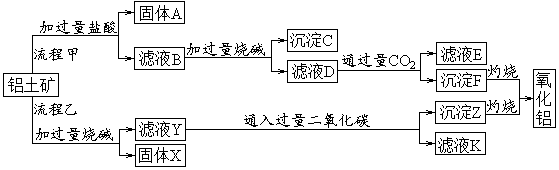
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
(2)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(3)滤液E、K中溶质的主要成份是_____(填化学式),写出该溶液的一种用途________
(4)已知298K时,Mg(OH)2的容度积常数Ksp=5.6×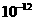 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=______。
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com